Hvorfor er væsker dårlige varmeledere?
Her er hvorfor:
* molekylær arrangement: I væsker er molekyler tættere sammen end i gasser, hvilket muliggør hyppigere kollisioner og energioverførsel. De er dog stadig længere fra hinanden og har svagere bindinger end faste stoffer.
* fri bevægelighed: Molekyler i væsker kan bevæge sig frit, hvilket gør det muligt at overføres varme gennem konvektion . Konvektion er processen med varmeoverførsel gennem bevægelse af væsker.
* densitet: Væsker er tættere end gasser, hvilket betyder, at der er flere molekyler pakket i et givet rum, hvilket letter flere kollisioner og varmeoverførsel.
Her er en sammenbrud af, hvorfor væsker er bedre ledere end gasser:
* Højere densitet: Flere molekyler i et givet rum betyder flere kollisioner og hurtigere varmeoverførsel.
* tættere afstand: Molekyler i væsker er tættere end gasser, hvilket muliggør mere direkte energioverførsel gennem kollisioner.
Væsker er imidlertid værre ledere end faste stoffer, fordi:
* svagere obligationer: Molekyler i væsker holdes sammen af svagere kræfter end i faste stoffer, hvilket gør det lettere for dem at bevæge sig rundt og forstyrre varmeoverførslen.
* mindre organiseret struktur: Væsker har mindre af en defineret struktur end faste stoffer, hvilket reducerer effektiviteten af varmeoverførsel gennem ledning.
Kortfattet:
Væsker falder i mellemgrunden, når det kommer til termisk ledningsevne. De er bedre ledere end gasser, men værre ledere end faste stoffer på grund af balancen mellem molekylær nærhed, bevægelse og bindingsstyrke.
 Varme artikler
Varme artikler
-
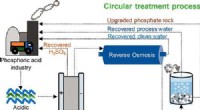 Forskere udvikler en metode til at omdanne farligt surt industrispildevand til værdifulde ressource…Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c03132 Et forskerhold af miljøforskere fra Ben-Gurion University of the Negev har udviklet en cirkulær proces til at
Forskere udvikler en metode til at omdanne farligt surt industrispildevand til værdifulde ressource…Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c03132 Et forskerhold af miljøforskere fra Ben-Gurion University of the Negev har udviklet en cirkulær proces til at -
 Tilslutning for at producere miljøvenlig bioplastKredit:Pixabay/CC0 Public Domain Bioplastik - bionedbrydelig plast fremstillet af biologiske stoffer i stedet for petroleum - kan fremstilles på en mere økonomisk og miljøvenlig måde ud fra biprod
Tilslutning for at producere miljøvenlig bioplastKredit:Pixabay/CC0 Public Domain Bioplastik - bionedbrydelig plast fremstillet af biologiske stoffer i stedet for petroleum - kan fremstilles på en mere økonomisk og miljøvenlig måde ud fra biprod -
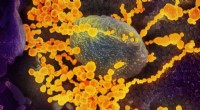 Forskere viser, at selvsteriliserende polymerer virker mod SARS-CoV-2Dette scanningselektronmikroskopbillede viser SARS-CoV-2 (runde guldobjekter), der dukker op fra overfladen af celler dyrket i laboratoriet. Kredit:NIAID-RML Forskere fra North Carolina State Un
Forskere viser, at selvsteriliserende polymerer virker mod SARS-CoV-2Dette scanningselektronmikroskopbillede viser SARS-CoV-2 (runde guldobjekter), der dukker op fra overfladen af celler dyrket i laboratoriet. Kredit:NIAID-RML Forskere fra North Carolina State Un -
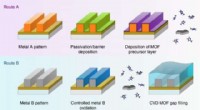 Ny isoleringsteknik baner vejen for kraftigere og mindre spånerFig. 1 Fra:Dampaflejrede zeolitiske imidazolat-rammer som huludfyldende ultra-lav-k-dielektrikum To foreslåede ruter til integration af ultra-lav-k MOF-dielektrik i on-chip-forbindelser via MOF-CVD-pr
Ny isoleringsteknik baner vejen for kraftigere og mindre spånerFig. 1 Fra:Dampaflejrede zeolitiske imidazolat-rammer som huludfyldende ultra-lav-k-dielektrikum To foreslåede ruter til integration af ultra-lav-k MOF-dielektrik i on-chip-forbindelser via MOF-CVD-pr
- Er vind en energikilde?
- Den kraft, det vil tage for at fremskynde en 900 kg bilhastighed på 3 ms, er?
- Hvad er de forskellige typer energi, og hvad deres anvendelser?
- Hvad er en fysisk egenskab ved glas?
- Amazon stopper byggeprojektet i Seattle før skatteafstemning
- Hvad er en forbindelse lavet af to giftige materialer natrium og chlorid?


