Hvorfor mister metaller lettere elektroner?
Elektronisk konfiguration:
* Få valenselektroner: Metaller har typisk 1, 2 eller 3 elektroner i deres yderste skal (Valence Shell). Disse valenselektroner er løst bundet til kernen og kan let fjernes.
* lav ioniseringsenergi: Den energi, der kræves for at fjerne et elektron fra et atom, kaldes ioniseringsenergi. Metaller har relativt lave ioniseringsenergier, hvilket gør det lettere at fjerne elektroner.
Metallisk binding:
* Elektronhavsmodel: Metaller holdes sammen af et "hav" af delokaliserede elektroner. Disse elektroner er ikke forbundet med noget bestemt atom og er frie til at bevæge sig gennem metalgitteret.
* Elektropositivitet: Metaller har en tendens til at være elektropositive, hvilket betyder, at de har en stærk tendens til at miste elektroner og danne positive ioner (kationer).
Her er grunden til, at dette gør metaller til gode ledere:
* De delokaliserede elektroner kan let bære elektrisk strøm.
* Den frie bevægelse af elektroner giver metaller mulighed for at udføre varme effektivt.
Kortfattet:
Metaller mister let elektroner på grund af deres lave ioniseringsenergier og tilstedeværelsen af løst bundne valenselektroner. Dette letter ved den metalliske binding, der muliggør delokalisering af elektroner og dannelsen af positive ioner. Denne egenskab gør metaller fremragende ledere af elektricitet og varme.
Sidste artikelHvordan påvirker Anbesol PBT?
Næste artikelHvorfor er væsker dårlige varmeledere?
 Varme artikler
Varme artikler
-
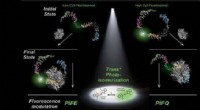 Ny eksperimentel indsigt giver forskere mulighed for at undersøge protein-DNA-interaktioner med stø…Den oprindelige tilstand af DNA-farvestofkomplekset bestemmer, om proteinbinding forøger eller slukker fluorescenssignalet. Kredit:KAUST En billedteknik med et enkelt molekyle, kaldet proteininduc
Ny eksperimentel indsigt giver forskere mulighed for at undersøge protein-DNA-interaktioner med stø…Den oprindelige tilstand af DNA-farvestofkomplekset bestemmer, om proteinbinding forøger eller slukker fluorescenssignalet. Kredit:KAUST En billedteknik med et enkelt molekyle, kaldet proteininduc -
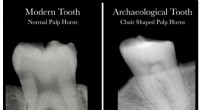 Videnskab møder arkæologi med opdagelsen af, at tandrøntgenstråler afslører D-vitaminmangelSammenligning af tandrøntgenbilleder fra patienter med og uden D-vitaminmangel. Kredit:McMaster University Menneskelige tænder rummer vital information om D-vitaminmangel, en alvorlig, men ofte sk
Videnskab møder arkæologi med opdagelsen af, at tandrøntgenstråler afslører D-vitaminmangelSammenligning af tandrøntgenbilleder fra patienter med og uden D-vitaminmangel. Kredit:McMaster University Menneskelige tænder rummer vital information om D-vitaminmangel, en alvorlig, men ofte sk -
 Traditionel eutektisk legering bringer nyt håb til metal-oxygenbatterier med høj energi densiteta) Sammenligning af oxidation og korrosionsbestandighed af Li-Na eutektisk legering og Na-metal. SEM-billeder til Li-Na-legering b), og Na c) elektroder efter fem stripping/pletteringscyklusser. d) Sp
Traditionel eutektisk legering bringer nyt håb til metal-oxygenbatterier med høj energi densiteta) Sammenligning af oxidation og korrosionsbestandighed af Li-Na eutektisk legering og Na-metal. SEM-billeder til Li-Na-legering b), og Na c) elektroder efter fem stripping/pletteringscyklusser. d) Sp -
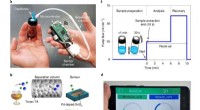 Bærbar smartphone-tilføjelse kan måle methanol i alkoholholdige drikkevarerAnalysator design. en, Den håndholdte analysator under måling. b, En skematisk oversigt over detekteringskonceptet. c, Prøveudtagning og analyseprocedure. d, Den skræddersyede app til at visualisere r
Bærbar smartphone-tilføjelse kan måle methanol i alkoholholdige drikkevarerAnalysator design. en, Den håndholdte analysator under måling. b, En skematisk oversigt over detekteringskonceptet. c, Prøveudtagning og analyseprocedure. d, Den skræddersyede app til at visualisere r
- Teoretikere beskrev en inertiel løft af partikler i mikrokanaler
- Når en række bjerge kan måles fra ti til hundrede kilometer i længden og bredden og er placeret …
- Hvor er Pepsin (Protease) placeret i kroppen?
- Fisk opgiver kampen efter koralblegning
- Hvorfor en ubalanceret kemisk ligning ikke fuldt ud kan beskrive en reaktion?
- Sådan fungerer kloning


