Hvorfor kan gasser komprimeres så let?
* Store intermolekylære rum: Gasmolekyler er langt fra hinanden med store tomme rum imellem. Dette gør dem meget komprimerbare.
* svage intermolekylære kræfter: Kræfterne til tiltrækning mellem gasmolekyler er meget svage. Disse kræfter er meget svagere end kræfterne i væsker og faste stoffer. Dette gør det muligt for molekylerne at bevæge sig frit og let pakkes tættere sammen.
* høj kinetisk energi: Gasmolekyler har høj kinetisk energi og er i konstant tilfældig bevægelse. Dette giver dem mulighed for let at udfylde den tilgængelige plads og reagere på ændringer i tryk.
hvordan komprimering fungerer:
Når der påføres tryk på en gas, skubbes gasmolekylerne tættere sammen. Dette reducerer det tomme rum mellem dem, hvilket resulterer i et fald i volumen. Det øgede tryk tvinger molekylerne til at bevæge sig hurtigere, hvilket også bidrager til faldet i volumen.
Eksempler på gaskomprimering:
* luftkompressorer: Disse enheder bruger mekaniske midler til at øge lufttrykket og komprimere det til et mindre volumen.
* køleskabe: Køleskabe bruger kølemidler, der er komprimeret og udvidet i en cyklus for at overføre varme.
* aerosol dåser: Den trykgas inden for aerosolbokser skubber produktet ud, når ventilen åbnes.
Kortfattet: Kombinationen af store intermolekylære rum, svage intermolekylære kræfter og høj kinetisk energi gør det let at komprimeres. Denne kompressibilitet er en vigtig egenskab for gasser og bruges i mange applikationer.
Sidste artikelElektroner opfører sig som hvad?
Næste artikelHvilken effekt har absorptionen af infrarød stråling på bindinger i CO2?
 Varme artikler
Varme artikler
-
 Forskere producerer første gang nogensinde videoer af kemisk syntese ved atomopløsningElektronmikroskopbilleder af testprøven ved forskellige forstørrelser. Kredit:(c) 2019 Nakamura et al. For første gang, forskere har formået at se tidligere utilgængelige detaljer om visse kemiske
Forskere producerer første gang nogensinde videoer af kemisk syntese ved atomopløsningElektronmikroskopbilleder af testprøven ved forskellige forstørrelser. Kredit:(c) 2019 Nakamura et al. For første gang, forskere har formået at se tidligere utilgængelige detaljer om visse kemiske -
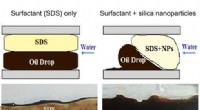 Nye materialer med vigtige anvendelser i forbedret oliegenvindingForskelle i bevægelsen af olie gennem mikrokanalerne ved tilsætning af overfladeaktivt stof i nærvær af silicananopartikler sammenlignet med det overfladeaktive middel alene, hvilket viser, hvordan
Nye materialer med vigtige anvendelser i forbedret oliegenvindingForskelle i bevægelsen af olie gennem mikrokanalerne ved tilsætning af overfladeaktivt stof i nærvær af silicananopartikler sammenlignet med det overfladeaktive middel alene, hvilket viser, hvordan -
 DNA er kun et blandt millioner af mulige genetiske molekylerKredit:CC0 Public Domain Biologi koder information i DNA og RNA, som er komplekse molekyler finjusteret til deres funktioner. Men er de den eneste måde at gemme arvelig molekylær information? Nogl
DNA er kun et blandt millioner af mulige genetiske molekylerKredit:CC0 Public Domain Biologi koder information i DNA og RNA, som er komplekse molekyler finjusteret til deres funktioner. Men er de den eneste måde at gemme arvelig molekylær information? Nogl -
 Superfleksible elektroluminescerende enheder udvikletUdvikling af superfleksible elektroluminescerende enheder. Kredit:Pusan National University Fremtiden vil blive farvet af bøj-at-vilje lyskilder. En succesfuld forskningsundersøgelse udført af e
Superfleksible elektroluminescerende enheder udvikletUdvikling af superfleksible elektroluminescerende enheder. Kredit:Pusan National University Fremtiden vil blive farvet af bøj-at-vilje lyskilder. En succesfuld forskningsundersøgelse udført af e
- Hvor langt er Neptune fra solen i miles?
- Radar afslører detaljer om bjergkollaps efter Nordkoreas seneste atomprøvesprængning
- Hvad er to kræfter, der virker på partiklerne inde i en tåge, der påvirker dens balance?
- Hvad sker der med dagslysperioden på den nordlige halvkugle efter den 21. juni?
- Hvorfor rejser en planet i en bane rundt om solen?
- Hvad er regionen på jordoverfladen med lignende højde?


