Elektroner opfører sig som hvad?
1. Bølger og partikler:
* bølgepartikel dualitet: Elektroner udviser både bølge-lignende og partikellignende egenskaber. Dette betyder, at de kan fungere som bølger (f.eks. Diffraktion gennem en spalte) og partikler (f.eks. At have en bestemt position og momentum).
2. Kvantemekaniske objekter:
* Kvantiserede energiniveau: Elektroner kan kun eksistere i specifikke energiniveauer inden for et atom, ikke derimellem. Dette forklarer den diskrete karakter af atomspektre.
* Sandsynlighedsfordeling: Den nøjagtige position og momentum for et elektron kan ikke kendes samtidig (Heisenbergs usikkerhedsprincip). Vi kan kun tale om sandsynligheden for at finde et elektron på et bestemt sted.
3. Ladede partikler:
* negativ opladning: Elektroner har en negativ ladning, som er den grundlæggende enhed for elektrisk ladning.
* Elektriske strømme: Strømmen af elektroner er det, der skaber elektriske strømme.
4. Byggesten til stof:
* atomstruktur: Elektroner kredserer kernen i et atom og danner elektronskaller. Deres arrangement bestemmer et atoms kemiske egenskaber.
* Kemiske bindinger: Elektroner deltager i dannelsen af kemiske bindinger mellem atomer og holder molekyler sammen.
5. Anden adfærd:
* spin: Elektroner har et iboende vinkelmoment kaldet spin, som kan betragtes som elektronet, der spinder på dens akse. Denne spin er kvantiseret og spiller en rolle i magnetisme.
* interaktion med lys: Elektroner kan absorbere og udsende lys, der påvirker farven på genstande og materialer.
Sammenfattende er elektroner komplekse og mangefacetterede partikler, der udviser både bølge-lignende og partikellignende opførsel, er underlagt kvantemekanikens love og spiller en vigtig rolle i stofens struktur og opførsel.
 Varme artikler
Varme artikler
-
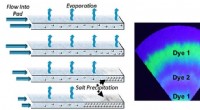 Papirbaseret enhed giver lavt strømforbrug, langsigtet metode til at analysere svedFordampningen af sved på papirpuder kunne bruges til væsketransport i wearables over lange perioder. Det resulterende tørre lag af kagede salte ville bevare en tidsstemplet registrering af biomarkør
Papirbaseret enhed giver lavt strømforbrug, langsigtet metode til at analysere svedFordampningen af sved på papirpuder kunne bruges til væsketransport i wearables over lange perioder. Det resulterende tørre lag af kagede salte ville bevare en tidsstemplet registrering af biomarkør -
 Brændstof fra udtjente dækKredit:CC0 Public Domain Brugte dæk udgør en alvorlig miljørisiko på grund af de skader, der kan opstå, når de opbevares i miljøet. De dukker op i stadig større antal fra det ene år til det andet
Brændstof fra udtjente dækKredit:CC0 Public Domain Brugte dæk udgør en alvorlig miljørisiko på grund af de skader, der kan opstå, når de opbevares i miljøet. De dukker op i stadig større antal fra det ene år til det andet -
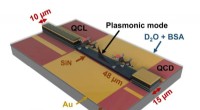 Miniaturiseret lab-on-a-chip til kemisk analyse af væsker i realtidOn-chip sensorkoncept inklusive angivet plasmonisk tilstand. Emitter (QCL, 10 μm bred) og detektor (QCD, 15 μm bred) er forbundet gennem en 48 μm lang tilspidset SiN-baseret plasmonisk bølgeleder. Hel
Miniaturiseret lab-on-a-chip til kemisk analyse af væsker i realtidOn-chip sensorkoncept inklusive angivet plasmonisk tilstand. Emitter (QCL, 10 μm bred) og detektor (QCD, 15 μm bred) er forbundet gennem en 48 μm lang tilspidset SiN-baseret plasmonisk bølgeleder. Hel -
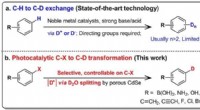 Præcis deuteration ved hjælp af tungt vandFigur viser sammenligningen mellem den konventionelle H/D-udveksling (baseret på CH-bindinger) og den nye tungvandssplittemetode (baseret på C-X-bindinger). Kredit:National University of Singapore
Præcis deuteration ved hjælp af tungt vandFigur viser sammenligningen mellem den konventionelle H/D-udveksling (baseret på CH-bindinger) og den nye tungvandssplittemetode (baseret på C-X-bindinger). Kredit:National University of Singapore
- Hvordan T-formede klynger driver lanthanid-separation under væske-væske-ekstraktion
- Sådan beregnes diameter kun med længde og bredde
- Hvilke ledere overfører partikler?
- Hvad er funktionen af grafit i en atomreaktor?
- Kollektiv læring er evnen til at lære og overføre andre?
- Hvorfor er det en god idé at tale politik med din fulde onkel


