Når molekylerne i en krop bevæger sig med øget hastighed, er det muligt, der vil ændre sig fra agas til flydende gas fast gas?
* øget molekylær bevægelse fører generelt til en faseændring fra et fast til en væske eller fra en væske til en gas .
Lad os nedbryde det:
* faste stoffer: Molekyler i faste stoffer er tæt pakket og vibrerer på plads.
* væsker: Molekyler i væsker har mere frihed til at bevæge sig rundt, men de er stadig relativt tæt sammen.
* Gasser: Molekyler i gasser har mest frihed. De er spredt og bevæger sig hurtigt rundt.
Når du øger temperaturen af et stof øger du den gennemsnitlige kinetiske energi af dets molekyler. Dette betyder, at molekylerne bevæger sig hurtigere.
Sådan relaterer det sig til faseændringer:
* fast til væske (smeltning): Når du tilsætter varme, går molekylerne i en fast vibrering hurtigere og slipper til sidst fri fra deres stive struktur og overgår til en væske.
* væske til gas (kogning/fordampning): Med endnu mere varme får molekyler nok energi nok til at undslippe væskens overflade fuldstændigt og blive en gas.
Det er vigtigt at bemærke:
* Det er ikke muligt for en gas at direkte blive et fast stof med øget molekylær bevægelse. Overgangen er nødt til at gennemgå den flydende fase.
* omvendt proces er også sand. Faldende molekylær bevægelse (afkøling) vil forårsage overgange fra gas til væske (kondens) eller fra væske til fast (frysning).
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse faseændringer!
 Varme artikler
Varme artikler
-
 Discovery booster teorien om, at liv på Jorden opstod fra RNA-DNA-blandingKredit:CC0 Public Domain Kemikere ved Scripps Research har gjort en opdagelse, der understøtter et overraskende nyt syn på, hvordan liv opstod på vores planet. I en undersøgelse offentliggjort i
Discovery booster teorien om, at liv på Jorden opstod fra RNA-DNA-blandingKredit:CC0 Public Domain Kemikere ved Scripps Research har gjort en opdagelse, der understøtter et overraskende nyt syn på, hvordan liv opstod på vores planet. I en undersøgelse offentliggjort i -
 Forskere beskriver strukturen af et potentielt luminescerende stofStrukturen af det nye stof. Kredit:Maksim Molokeev. En fysiker fra Siberian Federal University (SFU) og Kirensky Institute of Physics Federal Research Center KSC SB RAS (IF) har beskrevet strukt
Forskere beskriver strukturen af et potentielt luminescerende stofStrukturen af det nye stof. Kredit:Maksim Molokeev. En fysiker fra Siberian Federal University (SFU) og Kirensky Institute of Physics Federal Research Center KSC SB RAS (IF) har beskrevet strukt -
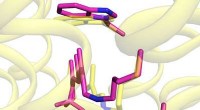 Lys-inducerede ændringer i form driver en pumpe i en marin bakterieFigur 1:Lysinducerede ændringer i strukturen (lyserøde stænger) nær en chloridion (blå kugle) er overlejret på hviletilstandsstrukturen af et pumpende protein (gult). Vandmolekyler er afbildet af rø
Lys-inducerede ændringer i form driver en pumpe i en marin bakterieFigur 1:Lysinducerede ændringer i strukturen (lyserøde stænger) nær en chloridion (blå kugle) er overlejret på hviletilstandsstrukturen af et pumpende protein (gult). Vandmolekyler er afbildet af rø -
 Tværfagligt samarbejde giver sværest, tyndeste belægninger endnu opdagetLehigh University-forskerne Nicholas Strandwitz (til venstre) og Brandon Krick (til højre) mener, at de har opdaget det sværeste, tyndeste, mest slidstærke belægninger endnu - plasma-forstærket atomla
Tværfagligt samarbejde giver sværest, tyndeste belægninger endnu opdagetLehigh University-forskerne Nicholas Strandwitz (til venstre) og Brandon Krick (til højre) mener, at de har opdaget det sværeste, tyndeste, mest slidstærke belægninger endnu - plasma-forstærket atomla
- Brandmænd kæmper for at beskytte kæmpe sequoias i Californiens brande
- Hvordan dannes metamorf rock?
- Neutrondiffraktionsforsøg af materialer med strukturer bestående af flere metalelementer
- Kan syrer forbrændes som brændstof?
- Hvilken træning gjorde Neil Armstrong for at være en astronat?
- Hvem sagde, at et atom har en lille positivt ladet kerne omgivet af stor region?


