Er kraften af tiltrækning stærkere i molekyler en fast eller væske?
Her er hvorfor:
* faste stoffer: Partikler i faste stoffer er tæt pakket sammen og har en fast, regelmæssig ordning. Denne nærhed og orden fører til stærke intermolekylære kræfter (tiltrækningskræfter mellem molekyler), der holder partiklerne fast på plads. Disse stærke kræfter begrænser bevægelsen, hvilket giver faste stoffer deres stive form og ukomprimerbarhed.
* væsker: Partikler i væsker er mindre tæt pakket end i faste stoffer og har en mindre ordnet ordning. De intermolekylære kræfter er svagere i væsker, hvilket gør det muligt for partikler at bevæge sig mere frit og tage formen på deres beholder. Mens kræfterne er svagere end i faste stoffer, er de stadig stærke nok til at holde partiklerne sammen, hvilket forhindrer, at væsken ekspanderer uendeligt.
Kortfattet: Styrken af intermolekylære kræfter bestemmer stoftilstanden. Faststoffer har stærke intermolekylære kræfter, væsker har svagere intermolekylære kræfter, og gasser har meget svage intermolekylære kræfter.
Sidste artikelEr polycarbonat en leder af elektricitet?
Næste artikelHvad er den tilstand, hvor et stof har en bestemt form og volumen?
 Varme artikler
Varme artikler
-
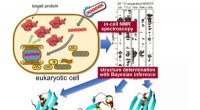 In-situ måling af 3-D proteinstruktur inde i levende eukaryote cellerMålproteiner udtrykkes indeni sf9 celler, derefter målt under anvendelse af in-cell NMR-spektroskopi. Unik statistisk analyse ved hjælp af Bayesiansk slutning anvendes til at beregne den nøjagtige
In-situ måling af 3-D proteinstruktur inde i levende eukaryote cellerMålproteiner udtrykkes indeni sf9 celler, derefter målt under anvendelse af in-cell NMR-spektroskopi. Unik statistisk analyse ved hjælp af Bayesiansk slutning anvendes til at beregne den nøjagtige -
 Et nyt værktøj til styring af reaktioner i mikrorobotter og mikroreaktorerThomas Russell og Ganhua Xie ved UMass Amherst og Lawrence Berkeley National Lab bruger kapillære kræfter til at udvikle en simpel metode til fremstilling af selvsamlende hængende dråber af en vandig
Et nyt værktøj til styring af reaktioner i mikrorobotter og mikroreaktorerThomas Russell og Ganhua Xie ved UMass Amherst og Lawrence Berkeley National Lab bruger kapillære kræfter til at udvikle en simpel metode til fremstilling af selvsamlende hængende dråber af en vandig -
 Hemmeligheder bag Lucretia maler tættere på at blive afsløretLucretias død. Kredit:Bowes Museum Mysteriet om hvem der malede et århundreder gammelt kunstværk, og når, er tættere på at blive afsløret takket være kunstbevaring og retsmedicinske eksperter fra
Hemmeligheder bag Lucretia maler tættere på at blive afsløretLucretias død. Kredit:Bowes Museum Mysteriet om hvem der malede et århundreder gammelt kunstværk, og når, er tættere på at blive afsløret takket være kunstbevaring og retsmedicinske eksperter fra -
 Klikreaktion for levende systemer:Bioortogonal hydroaminering af aktiverede lineære alkynerKredit:CC0 Public Domain At øge vores forståelse af cellulære processer kræver information om de involverede typer biomolekyler, deres placeringer, og deres interaktioner. Dette kræver, at molekyl
Klikreaktion for levende systemer:Bioortogonal hydroaminering af aktiverede lineære alkynerKredit:CC0 Public Domain At øge vores forståelse af cellulære processer kræver information om de involverede typer biomolekyler, deres placeringer, og deres interaktioner. Dette kræver, at molekyl
- Ændring af tilstand fra en gas til væske?
- Hvordan kan luft spille en rolle i kemisk forvitring?
- Oversvømmelsestruede befolkninger steg med næsten 25 % siden 2000:undersøgelse
- Nanodiamonds producerer Game Changing Event for MRI-billedfølsomhed
- Hvad er 38,4 grader i Fahrenheit?
- Ny undersøgelse undersøger 2017-2018 Thomas Fire-affaldsstrømme


