Hvilken type binding samles elektroner?
Her er hvorfor:
* kovalente obligationer form, når to atomer deler elektroner for at opnå en stabil elektronkonfiguration. Denne deling skaber en pulje af elektroner, som begge atomer kan få adgang til.
* ioniske bindinger Involver overførsel af elektroner, hvor det ene atom mister elektroner og bliver positivt ladet, mens de andre får elektroner og bliver negativt ladet. De holdes derefter sammen af elektrostatisk tiltrækning.
* Metalliske obligationer Inddrag et "hav" af delokaliserede elektroner, der deles af alle metalatomer i et fast stof. Mens elektroner samles, er det ikke mellem to specifikke atomer som i en kovalent binding.
Eksempel: I et vandmolekyle (H₂O) deler iltatomet elektroner med hvert af de to hydrogenatomer, der danner kovalente bindinger. Denne delte pulje af elektroner bidrager til den samlede stabilitet af vandmolekylet.
Sidste artikelHvad dannes, når elektroner deles af to atomer?
Næste artikelBliver gasmolekyler større, når de opvarmes?
 Varme artikler
Varme artikler
-
 Verdens første opdagelse kan give næring til den nye grønne ammoniakøkonomiKredit:CC0 Public Domain I en verdensnyhed, Monash University-forskere har udviklet en ny, miljøvenlig proces, der kan drive den fremtidige produktion af grøn ammoniak. Ammoniak (NH 3 ) er en g
Verdens første opdagelse kan give næring til den nye grønne ammoniakøkonomiKredit:CC0 Public Domain I en verdensnyhed, Monash University-forskere har udviklet en ny, miljøvenlig proces, der kan drive den fremtidige produktion af grøn ammoniak. Ammoniak (NH 3 ) er en g -
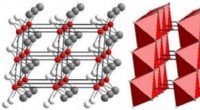 Mineralopdagelse gjort nemmere:Røntgenteknik kaster nyt lys på bittesmå, sjældne krystallerDisse diagrammer viser atomkrystalstrukturen af ognitit. Til venstre, atomer i den krystallinske struktur er repræsenteret i rødt (nikkel), hvid (tellur), og grå (vismut). Til højre, en polyhedral r
Mineralopdagelse gjort nemmere:Røntgenteknik kaster nyt lys på bittesmå, sjældne krystallerDisse diagrammer viser atomkrystalstrukturen af ognitit. Til venstre, atomer i den krystallinske struktur er repræsenteret i rødt (nikkel), hvid (tellur), og grå (vismut). Til højre, en polyhedral r -
 Effektiv titanium-baseret katalysator, der bruges til at producere PEF, biobaseret alternativ til PE…Kredit:Angewandte Chemie En mulig erstatning for drikkevarebeholdere lavet af PET er polyethylenfurandicarboxylat (PEF), fremstillet af vedvarende ressourcer. Produktionen af råvaren til PEF fra
Effektiv titanium-baseret katalysator, der bruges til at producere PEF, biobaseret alternativ til PE…Kredit:Angewandte Chemie En mulig erstatning for drikkevarebeholdere lavet af PET er polyethylenfurandicarboxylat (PEF), fremstillet af vedvarende ressourcer. Produktionen af råvaren til PEF fra -
 Forudsigelse af kemiske processer for at hjælpe landbrugsvirksomheder, kosmetik, brændstof- og fø…Vagtel forudsigelse af en koffein orbital i vand. Åbne grænseforhold afslører udvidede elektroniske tilstande – i modsætning til avancerede modeller. Quail Modelng LLC har udviklet software til bedre
Forudsigelse af kemiske processer for at hjælpe landbrugsvirksomheder, kosmetik, brændstof- og fø…Vagtel forudsigelse af en koffein orbital i vand. Åbne grænseforhold afslører udvidede elektroniske tilstande – i modsætning til avancerede modeller. Quail Modelng LLC har udviklet software til bedre
- Hvad er udseendet af sukker og salt, når det blev opløst?
- Undersøgelse:Unge erfaringer med politiet har skadelige konsekvenser for senere liv
- Brug af marinerede æg til at demonstrere diffusion
- Hvilken effekt har vippet på højden af sol og fuldmåne?
- Hvorfor skulle den dybde, hvorpå en klippe dannes, bestemmer dens type?
- Hvordan man laver en Ladybug Habitat


