Er Boyles Law anvendelig på væsker?
* Boyle's Law siger: Mængden af en gas er omvendt proportional med dens tryk under forudsætning af konstant temperatur. Dette forhold opstår fra komprimerbarheden af gasser.
* væsker er relativt ukomprimerbare: I modsætning til gasser har væsker meget stærkere intermolekylære kræfter, der holder deres molekyler tæt sammen. Dette gør dem meget mindre komprimerbare. Anvendelse af pres på en væske vil kun forårsage en meget lille ændring i dens volumen.
Der er dog nogle indirekte måder, som Boyle's lov kan være involveret på:
* Løsninger: Hvis en gas opløses i en væske, vil gasens tryk over opløsningen påvirke opløseligheden af gassen i væsken. Dette er relateret til Henrys lov, der er analog med Boyle's lov for gasser opløst i væsker.
* damptryk: Væsker har et damptryk, der påvirkes af temperaturen. Dette damptryk kan betragtes som en gas i ligevægt med væsken, og Boyle's lov vil gælde for gasfasen.
I det væsentlige, mens Boyle's lov ikke direkte gælder for væskens bulkopførsel, kan principperne bag det stadig påvirke visse fænomener, der involverer væsker og gasser.
 Varme artikler
Varme artikler
-
 Naturen er en nøgle til at afvise væskerBefugtende overflader med mikrosøjler (til venstre) mister deres omnifobicitet, når de beskadiges, mens mikroteksturer med dobbelt tilbagevendende hulrum (højre) udviser omnifobicitet trods lokalisere
Naturen er en nøgle til at afvise væskerBefugtende overflader med mikrosøjler (til venstre) mister deres omnifobicitet, når de beskadiges, mens mikroteksturer med dobbelt tilbagevendende hulrum (højre) udviser omnifobicitet trods lokalisere -
 Hvordan blækspruttecamouflage kan hjælpe med at forhindre hudkræft hos menneskerEt team af nordøstlige forskere bruger kemien i blækspruttehud til at skabe en bærbar enhed, der registrerer skadelige niveauer af UV-stråling. Kredit:Alyssa Stone/Northeastern University Det var i
Hvordan blækspruttecamouflage kan hjælpe med at forhindre hudkræft hos menneskerEt team af nordøstlige forskere bruger kemien i blækspruttehud til at skabe en bærbar enhed, der registrerer skadelige niveauer af UV-stråling. Kredit:Alyssa Stone/Northeastern University Det var i -
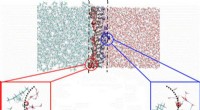 Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsprocesHvordan molekyler bevæger sig og organiserer sig i vand, når væsken møder olien, afhænger af, om kemikaliet er på toppen eller truget af en lille bølge af vand ved grænsefladen. Kredit:US Department o
Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsprocesHvordan molekyler bevæger sig og organiserer sig i vand, når væsken møder olien, afhænger af, om kemikaliet er på toppen eller truget af en lille bølge af vand ved grænsefladen. Kredit:US Department o -
 SwRI-udviklet mobilsystem til at ødelægge farlige kemiske krigsførende stoffer på stedetSwRI er ved at udvikle en mobil behandlingsenhed (til venstre) til at ødelægge kemiske midler. Efter at agenterne er blevet ødelagt, Udstødningsgasser ledes gennem et jordbaseret fluid bed og scrubber
SwRI-udviklet mobilsystem til at ødelægge farlige kemiske krigsførende stoffer på stedetSwRI er ved at udvikle en mobil behandlingsenhed (til venstre) til at ødelægge kemiske midler. Efter at agenterne er blevet ødelagt, Udstødningsgasser ledes gennem et jordbaseret fluid bed og scrubber
- Hvad er den kraft, der gør det muligt for Rocket at accelerere opad?
- Hvordan involverer acceleration en chnage i retning og hastighed?
- Kolde Coulomb-krystaller, kosmiske spor:Optrævling af rumkemiens mysterier
- Mineaffald kunne bruges som ingrediens til billigere brintbrændstofproduktion
- Idéer om Rainbow Science Fair Projects
- Inane indflydelse:Hvordan useriøse produktanmeldelser påvirker onlinesalg


