Har elementerne i iltfamilien en tendens til at vinde eller miste elektroner kemiske reaktioner?
Her er hvorfor:
* Elektronkonfiguration: Oxygenfamilieelementer har seks elektroner i deres yderste skal. De har brug for yderligere to elektroner for at opnå en stabil, ædelgaskonfiguration.
* Elektronegativitet: Oxygenfamilieelementer er meget elektronegative, hvilket betyder, at de har en stærk attraktion for elektroner.
* Oxidationstilstand: Den mest almindelige oxidationstilstand for disse elementer er -2, hvilket indikerer, at de får to elektroner.
Eksempler:
* ilt (O): Formularer oxidioner (O²⁻) ved at få to elektroner.
* svovl (er): Former sulfidioner (s²⁻) ved at få to elektroner.
* selen (SE): Former selenidioner (se²⁻) ved at få to elektroner.
Undtagelser:
Mens den mest almindelige tendens er at få elektroner, kan nogle elementer i iltfamilien udvise positive oxidationstilstande i visse forbindelser. For eksempel kan svovl have en +6 oxidationstilstand i svovlsyre (H₂so₄).
Key Takeaway: Generelt er det mere sandsynligt, at elementer i iltfamilien får elektroner for at opnå en stabil elektronkonfiguration.
 Varme artikler
Varme artikler
-
 Kemisk proces nedbryder lignin og gør birketræ til brugbare kemiske produkterDette billede viser den kemiske reaktor, der blev brugt i undersøgelsen til at spalte træ til træmasse og ligninolie. Kredit:KU Leuven Et team af forskere tilknyttet flere institutioner i Belgien
Kemisk proces nedbryder lignin og gør birketræ til brugbare kemiske produkterDette billede viser den kemiske reaktor, der blev brugt i undersøgelsen til at spalte træ til træmasse og ligninolie. Kredit:KU Leuven Et team af forskere tilknyttet flere institutioner i Belgien -
 Naturlig blå madfarve får et miljøvenligt produktionsløftKredit:Pixabay/CC0 Public Domain Forskere har udviklet en miljøvenlig måde at øge produktionen og varmestabiliteten af en naturlig blå farve. Brugt i alt fra Smarties til gin, den blå farve, ke
Naturlig blå madfarve får et miljøvenligt produktionsløftKredit:Pixabay/CC0 Public Domain Forskere har udviklet en miljøvenlig måde at øge produktionen og varmestabiliteten af en naturlig blå farve. Brugt i alt fra Smarties til gin, den blå farve, ke -
 Forskere bygger en holdbar molekylær krypteringsnøgle af sekvensdefinerede polymererEn molekylær krypteringsnøgle blev indlejret i blæk (venstre billede) af et brev (højre billede), som blev sendt og analyseret for at dekryptere en fil. Kredit:Tilpasset fra ACS Central Science . M
Forskere bygger en holdbar molekylær krypteringsnøgle af sekvensdefinerede polymererEn molekylær krypteringsnøgle blev indlejret i blæk (venstre billede) af et brev (højre billede), som blev sendt og analyseret for at dekryptere en fil. Kredit:Tilpasset fra ACS Central Science . M -
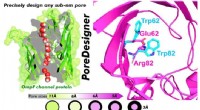 PoreDesigner forbedrer proteinkanaldesign til vandbehandling, bioseparationerFigur, der skitserer det grundlæggende i PoreDesigners arbejdsgang til ændring af porestørrelsen af et bakteriekanalprotein. Kredit:Manish Kumar / Penn State PoreDesigner, en fuldt automatiseret
PoreDesigner forbedrer proteinkanaldesign til vandbehandling, bioseparationerFigur, der skitserer det grundlæggende i PoreDesigners arbejdsgang til ændring af porestørrelsen af et bakteriekanalprotein. Kredit:Manish Kumar / Penn State PoreDesigner, en fuldt automatiseret
- Størrelsen på de mineralkrystaller, der findes i en stødende klippe, er direkte relateret til?
- Hvordan ville det at studere en kystlinje hjælpe videnskabsmand med at finde ud af, at der havde væ…
- Flyrejser og klima:En potentiel ny feedback?
- Bløde og behagelige e-tekstiler, der kan bruges til at måle fotoplenthysmografi
- Et skråt fly gør arbejdet lettere ved at øge afstanden og den tomme kraft.?
- Hvordan katalysatorerne i biler går dårligt, og hvorfor det betyder noget


