Når opløsningspartikler tilsættes til et rent opløsningsmiddel i lukket beholder ved konstant temperatur og pressuer damptrykket?
Her er hvorfor:
* damptryk: Damptrykket af en væske er det tryk, der udøves af dets damp, når væsken og dampen er i ligevægt.
* Solute-opløsningsmiddelinteraktioner: Når der tilsættes et opløst stof til et opløsningsmiddel, interagerer de opløste partikler med opløsningsmidletmolekylerne. Disse interaktioner kan være stærkere eller svagere end de opløsningsmiddelopløsningsmiddelinteraktioner.
* reduceret opløsningsmiddeloverfladeareal: Tilstedeværelsen af opløste partikler reducerer overfladearealet af opløsningsmidlet udsat for dampfasen.
* lavere flugthastighed: Med et reduceret overfladeareal og stærkere interaktioner har opløsningsmiddelmolekylerne en lavere chance for at flygte ind i dampfasen, hvilket resulterer i et lavere damptryk.
M
* p løsning =X opløsningsmiddel * P opløsningsmiddel
hvor:
* P løsning er opløsningens damptryk
* X opløsningsmiddel er molfraktionen af opløsningsmidlet i opløsningen
* P opløsningsmiddel er damptrykket af det rene opløsningsmiddel
Vigtig note: Denne forklaring antager en ideel løsning, hvor opløsningsmiddel- og opløsningsmiddelmolekylerne interagerer på samme måde som hinanden. I scenarier i den virkelige verden kan afvigelser fra Raoults lov forekomme.
 Varme artikler
Varme artikler
-
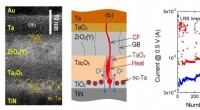 En optimeret struktur af memristiv enhed til neuromorfe computersystemerHøjopløselig transmissionselektronmikroskopibillede (a) og skematisk (b) af tværsnittet af flerlags memristive strukturen i området for den ledende filament (CF), afhængigheden af resistive tilstand
En optimeret struktur af memristiv enhed til neuromorfe computersystemerHøjopløselig transmissionselektronmikroskopibillede (a) og skematisk (b) af tværsnittet af flerlags memristive strukturen i området for den ledende filament (CF), afhængigheden af resistive tilstand -
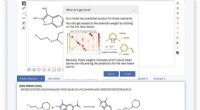 Brug af neurale netværk til at forudsige resultaterne af organisk kemiDet webbaserede værktøj er enkelt, og modellen er uddannet fra ende til anden, fuldt datadrevet og uden hjælp til forespørgsel i en database eller yderligere eksterne oplysninger. Kredit:IBM I mer
Brug af neurale netværk til at forudsige resultaterne af organisk kemiDet webbaserede værktøj er enkelt, og modellen er uddannet fra ende til anden, fuldt datadrevet og uden hjælp til forespørgsel i en database eller yderligere eksterne oplysninger. Kredit:IBM I mer -
 Forskere bestemmer den komplekse struktur af receptorerne relateret til opioidafhængighedKredit:Pixabay/CC0 Public Domain En undersøgelse offentliggjort i Pharmacological Research afslører den oligomere molekylære struktur af MOR-Gal1R-komplekset, en komponent til stede i hjernen, som
Forskere bestemmer den komplekse struktur af receptorerne relateret til opioidafhængighedKredit:Pixabay/CC0 Public Domain En undersøgelse offentliggjort i Pharmacological Research afslører den oligomere molekylære struktur af MOR-Gal1R-komplekset, en komponent til stede i hjernen, som -
 Ny tilgang vil hjælpe med at identificere lægemidler, der kan lime proteiner sammenKredit:Pixabay/CC0 Public Domain En ny screeningsmetode, der kan teste effektiviteten af terapeutiske molekyler designet til at lime proteiner sammen i kroppen, er udviklet af forskere ved Unive
Ny tilgang vil hjælpe med at identificere lægemidler, der kan lime proteiner sammenKredit:Pixabay/CC0 Public Domain En ny screeningsmetode, der kan teste effektiviteten af terapeutiske molekyler designet til at lime proteiner sammen i kroppen, er udviklet af forskere ved Unive
- Hvad er den fysiske tilstand af svovl ved 300 grader celsius?
- For mange efterladt:Svigtende COVID-19-forebyggende foranstaltninger i uformelle bosættelser
- Hvordan overføres energien fra sol til Jorden?
- Hvad kaldes en stiv sprød klippe?
- Hvad er jordens gravitationsfelt?
- Middelhavet er afgrænset af hvad tre kontinenter?


