Hvorfor er ledning i gasser langsommere end flydende eller faste stoffer?
* afstand: Gasmolekyler er langt fra hinanden sammenlignet med væsker og faste stoffer. Dette betyder, at der er en masse tomme mellemrum mellem dem.
* Kollisioner: Varmeoverførsel gennem ledning er afhængig af kollisioner mellem molekyler. I gasser er kollisioner mindre hyppige på grund af de større afstande mellem molekyler.
* Energioverførsel: Når et gasmolekyle absorberer varme, vibrerer det og kolliderer med sine naboer og overfører noget af sin energi. På grund af den sparsomme karakter af gasser sker denne energioverførsel imidlertid meget mindre effektivt end i væsker eller faste stoffer.
I modsætning:
* væsker: Molekyler i væsker er tættere sammen, hvilket muliggør hyppigere kollisioner og en hurtigere overførsel af varmeenergi.
* faste stoffer: I faste stoffer er molekyler tæt pakket og holdes i en stiv struktur. Dette giver mulighed for meget effektiv energioverførsel gennem vibrationer.
Kortfattet: Den lave tæthed og store afstand mellem molekyler i gasser gør dem til dårlige ledere af varme sammenlignet med væsker og faste stoffer.
 Varme artikler
Varme artikler
-
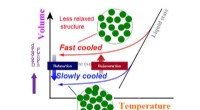 Skræddersyet hærdning af bulk metallisk glas induceret af 2-D gradientforyngelseEn skematisk illustration af metallisk glas med forskellige afslapningstilstande afhængigt af afkølingshastigheden. Kredit:Tohoku University Et team på Tohoku University har perfektioneret en ny v
Skræddersyet hærdning af bulk metallisk glas induceret af 2-D gradientforyngelseEn skematisk illustration af metallisk glas med forskellige afslapningstilstande afhængigt af afkølingshastigheden. Kredit:Tohoku University Et team på Tohoku University har perfektioneret en ny v -
 Multipel myrelignende transport af neuronal last med motorproteinerGodstransport med mange motorer gør neuronal aktivitet fin. Kredit:Kumiko Hayashi Mikrotubuli er veje lavet af proteiner, der strækker sig gennem en celle for motorproteiner (bærere) til at levere
Multipel myrelignende transport af neuronal last med motorproteinerGodstransport med mange motorer gør neuronal aktivitet fin. Kredit:Kumiko Hayashi Mikrotubuli er veje lavet af proteiner, der strækker sig gennem en celle for motorproteiner (bærere) til at levere -
 Ultrastrækbare og deformerbare bioprober ved hjælp af Kirigami-designUltrastrækbar Kirigami bioprobe enhed. Den strakte enhed (øverste billede) og enheden placeret over det biologiske væv (nederste billede). Kredit:Toyohashi University of Technology. Et forskerhold
Ultrastrækbare og deformerbare bioprober ved hjælp af Kirigami-designUltrastrækbar Kirigami bioprobe enhed. Den strakte enhed (øverste billede) og enheden placeret over det biologiske væv (nederste billede). Kredit:Toyohashi University of Technology. Et forskerhold -
 Forskere løser det 100-årige metallurgipuslespilFor at forstå præcis, hvordan metaller reagerer på højhastighedskomprimering i molekylære dynamiksimuleringer, LLNL -forskere bruger nye metoder til silikomikroskopi til at afsløre defekter i krystalg
Forskere løser det 100-årige metallurgipuslespilFor at forstå præcis, hvordan metaller reagerer på højhastighedskomprimering i molekylære dynamiksimuleringer, LLNL -forskere bruger nye metoder til silikomikroskopi til at afsløre defekter i krystalg
- Hvad er antallet af mol i 100 g MgCO3?
- Hvad er neurale celler?
- Bryder folierede metamorfe klipper langs deres ydre kanter?
- Is that light energy or heat of solar is converted into the electric energy?
- Kan mutationer, der forekommer i somatiske celler, overføres til et organismer afkom?
- Efter 90 år, en bedre måde at måle sammensætningen af papir på


