Hvad får entropi til at ændre sig, når en opløst stof opløses i opløsningsmiddel?
1. Forøget molekylær lidelse:
* opløst: Når en opløsning opløses, bliver dens molekyler mere spredte og spredt ud over opløsningsmidlet. Dette fører til et større antal mulige arrangementer for de opløste molekyler, hvilket øger systemets entropi.
* opløsningsmiddel: Opløsningsmiddelmolekylerne oplever også en ændring i deres arrangement, når de interagerer med opløsningen. Denne interaktion kan føre til både en stigning og fald i opløsningsmiddel entropi afhængigt af de specifikke interaktioner.
2. Blanding af molekyler:
* Processen med opløsning involverer blanding af opløst stof og opløsningsmiddelmolekyler. Denne blanding fører til en stigning i det samlede antal mulige mikrostater for systemet, hvilket i sidste ende øger entropien.
3. Hydrogenbinding:
* I tilfælde, hvor hydrogenbinding er signifikant (f.eks. Opløsning af sukker i vand), kan dannelsen af nye brintbindinger mellem opløst stof og opløsningsmiddelmolekyler bidrage til en stigning i entropi.
4. Ionisering:
* Når ioniske forbindelser opløses, adskiller de sig til ioner, hvilket yderligere kan øge entropien på grund af det øgede antal uafhængige partikler i opløsning.
Faktorer, der påvirker entropiændring:
* opløsningsmiddel og opløsningsmiddelegenskaber: Arten af det opløste og opløsningsmiddel (polaritet, størrelse og form) spiller en afgørende rolle i bestemmelsen af omfanget af entropiændring.
* Koncentration: Entropiændringen ved opløsning er større ved lavere koncentrationer, da molekylerne har mere plads til at bevæge sig rundt.
* Temperatur: Entropi øges generelt med stigende temperatur.
Generelt er entropiændringen ved opløsning en kompleks proces påvirket af flere faktorer. Imidlertid er den generelle tendens, at opløsning af et opløst stof fører til en stigning i entropi på grund af den øgede molekylære lidelse og blanding af molekyler.
 Varme artikler
Varme artikler
-
 Hærens forskere gør en eksplosiv opdagelseDiaminoglyoxim er vist i forgrunden, efter filtrering og tørring fra reaktionsblandingen. I baggrunden, DAG syntetiseres i et par 500 grams vægte. Kredit:Eric C. Johnson Forskere fra U.S. Army Res
Hærens forskere gør en eksplosiv opdagelseDiaminoglyoxim er vist i forgrunden, efter filtrering og tørring fra reaktionsblandingen. I baggrunden, DAG syntetiseres i et par 500 grams vægte. Kredit:Eric C. Johnson Forskere fra U.S. Army Res -
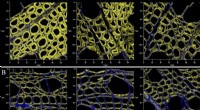 Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæringORNL -forskere brugte sofistikerede laserscanningsteknikker til at sammenligne nedbrydningen af fermenteret populær (B) sammenlignet med ugæret populær (A), som de kvantificerede, for første gang, k
Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæringORNL -forskere brugte sofistikerede laserscanningsteknikker til at sammenligne nedbrydningen af fermenteret populær (B) sammenlignet med ugæret populær (A), som de kvantificerede, for første gang, k -
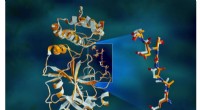 Røntgenstråler gør proteinstrukturen større i hjertet af COVID-19-virusOverlappende røntgendata for SARS-CoV-2-hovedproteasen viser strukturelle forskelle mellem proteinet ved stuetemperatur (orange) og den kryogenfrosne struktur (hvid). Kredit:Jill Hemman/ORNL, US Depar
Røntgenstråler gør proteinstrukturen større i hjertet af COVID-19-virusOverlappende røntgendata for SARS-CoV-2-hovedproteasen viser strukturelle forskelle mellem proteinet ved stuetemperatur (orange) og den kryogenfrosne struktur (hvid). Kredit:Jill Hemman/ORNL, US Depar -
 Forskere opretter en enhed til at identificere risici for brystkræftDemonstration af koncentrationsgradient i mikrofluidsystem ved hjælp af røde og blå farvestofopløsninger. Kredit:Purdue University Forskere ved Purdue University er ved at skabe en enhed, som de h
Forskere opretter en enhed til at identificere risici for brystkræftDemonstration af koncentrationsgradient i mikrofluidsystem ved hjælp af røde og blå farvestofopløsninger. Kredit:Purdue University Forskere ved Purdue University er ved at skabe en enhed, som de h


