Når 3,00 g mg antændes i 2,20 rent ilt Hvad den begrænsende reaktant og teoretisk udbytte MgO?
1. Afbalanceret kemisk ligning:
Reaktionen mellem magnesium (Mg) og ilt (O₂) producerer magnesiumoxid (MGO):
2 mg + o₂ → 2 mgo
2. Konverter masser til mol:
* mg:
* Mol mg =(masse af mg) / (molmasse mg)
* Mol mg =(3,00 g) / (24,31 g / mol) =0,123 mol
* o₂:
* Mol O₂ =(Mass of O₂) / (Molær masse O₂)
* Mol O₂ =(2,20 g) / (32,00 g / mol) =0,0688 mol
3. Bestem den begrænsende reaktant:
* Brug molforholdet fra den afbalancerede ligning: Ligningen viser, at 2 mol mg reagerer med 1 mol O₂.
* Beregn molen af O₂, der er nødvendig for at reagere fuldstændigt med de givne mol af Mg:
* (0,123 mol mg) * (1 mol o₂ / 2 mol mg) =0,0615 mol o₂
* Sammenlign de beregnede mol af O₂, der er nødvendig med den faktiske mol af O₂ tilgængelig:
* Vi har brug for 0,0615 mol o₂, men vi har kun 0,0688 mol o₂. Dette betyder, at vi har nok ilt.
* Konklusion: Magnesium (Mg) er den begrænsende reaktant, fordi det vil blive fuldstændigt konsumeret, før alle ilt reagerer.
4. Beregn det teoretiske udbytte af Mgo:
* Brug molforholdet fra den afbalancerede ligning: Ligningen viser, at 2 mol mg producerer 2 mol MGO.
* Beregn molen af MgO produceret fra den begrænsende reaktant (Mg):
* (0,123 mol mg) * (2 mol mgo / 2 mol mg) =0,123 mol mgo
* konverter mol mgo til gram:
* Mass af Mgo =(mol mgo) * (molmasse mgo)
* Masse MgO =(0,123 mol) * (40,30 g/mol) =4,96 g MgO
Derfor:
* Begrænsende reaktant: Magnesium (mg)
* Teoretisk udbytte af MGO: 4,96 g
Sidste artikelHvilken væske udvides mest, når de opvarmes?
Næste artikelKemiske bindinger omdannes til en potent form for energi kendt som?
 Varme artikler
Varme artikler
-
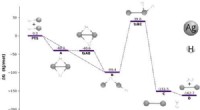 Kvantekemikere fremmaner opskrift til at blive guld, sølv og kobber i beholdere med grøn energiGratis energiprofil for reaktionen, der involverer AgH -monomerer. D svarer til Ag2- og H2 -molekylerne ved dissociationsgrænsen. Alle de frie energier (i kJ ⋅ mol − 1) blev opnået ved MP2/aug-cc-pVQZ
Kvantekemikere fremmaner opskrift til at blive guld, sølv og kobber i beholdere med grøn energiGratis energiprofil for reaktionen, der involverer AgH -monomerer. D svarer til Ag2- og H2 -molekylerne ved dissociationsgrænsen. Alle de frie energier (i kJ ⋅ mol − 1) blev opnået ved MP2/aug-cc-pVQZ -
 Ren teknologi til fremstilling af lavmolekylær chitosanPlasma-assisteret depolymerisation af chitosan i en kvartsblandingsanordning. Kredit:MIPT Forskere ved MIPT har udviklet en ny teknik til at opnå lavmolekylær vægt, vandopløseligt kitin og chitosa
Ren teknologi til fremstilling af lavmolekylær chitosanPlasma-assisteret depolymerisation af chitosan i en kvartsblandingsanordning. Kredit:MIPT Forskere ved MIPT har udviklet en ny teknik til at opnå lavmolekylær vægt, vandopløseligt kitin og chitosa -
 Hvor farlig er mikroplast?Mikroskopisk billede af en vandloppe (Daphnia magna) og Raman mikroskopisk analyse af et segment (grøn ramme i venstre billede) i dyrets tarm. De magentafarvede områder i det højre billede viser PVC-p
Hvor farlig er mikroplast?Mikroskopisk billede af en vandloppe (Daphnia magna) og Raman mikroskopisk analyse af et segment (grøn ramme i venstre billede) i dyrets tarm. De magentafarvede områder i det højre billede viser PVC-p -
 Forskere finder nøglen til at bevare SkrigetSkriget (1910?) (Munch Museum, Oslo; katalog n. Woll.M.896). Kredit:Irina Crina Anca Sandu og Eva Storevik Tveit, Munch Museum. Skriget er blandt de mest berømte malerier i den moderne æra. Det ve
Forskere finder nøglen til at bevare SkrigetSkriget (1910?) (Munch Museum, Oslo; katalog n. Woll.M.896). Kredit:Irina Crina Anca Sandu og Eva Storevik Tveit, Munch Museum. Skriget er blandt de mest berømte malerier i den moderne æra. Det ve


