Hvorfor udvides gasser hurtigere end væsker og faste stoffer?
* Intermolekylære kræfter: Gasser har meget svage intermolekylære kræfter. Molekylerne er langt fra hinanden og interagerer meget lidt. Dette giver dem mulighed for at bevæge sig frit og uafhængigt og reagere hurtigt på ændringer i tryk eller temperatur. Væsker og faste stoffer har stærkere intermolekylære kræfter, der holder deres molekyler tættere sammen og begrænser deres bevægelse.
* densitet: Gasser er meget mindre tætte end væsker og faste stoffer. Dette betyder, at der er mere plads mellem gasmolekyler, hvilket giver dem større frihed til at bevæge sig og udvide.
* Kompressibilitet: Gasser er meget komprimerbare, hvilket betyder, at deres volumen let kan reduceres ved at anvende tryk. Dette skyldes, at der er en masse tom plads mellem gasmolekylerne. Væsker og faste stoffer er meget mindre komprimerbare.
* kinetisk energi: Gasmolekyler har højere kinetisk energi (bevægelsesenergi) end flydende eller faste molekyler ved den samme temperatur. Dette betyder, at de bevæger sig hurtigere og kolliderer oftere, hvilket fører til hurtigere ekspansion, når de udsættes for ændringer i tryk eller temperatur.
Kortfattet: Kombinationen af svage intermolekylære kræfter, lav densitet, høj kompressibilitet og høj kinetisk energi i gasser giver dem mulighed for at udvide meget hurtigere end væsker og faste stoffer som respons på ændringer i deres miljø.
 Varme artikler
Varme artikler
-
 Hvad får en kæmpe vandmand til at stikke dødeligtKredit:CC0 Public Domain Med sommeren på vej, og nogle strande genåbner efter COVID-19-nedlukninger, folk vil tage til havet for at køle af på en varm dag. Men dem, der er uheldige nok til at stød
Hvad får en kæmpe vandmand til at stikke dødeligtKredit:CC0 Public Domain Med sommeren på vej, og nogle strande genåbner efter COVID-19-nedlukninger, folk vil tage til havet for at køle af på en varm dag. Men dem, der er uheldige nok til at stød -
 Lavpris, skalerbar vandspaltning giver næring til fremtidens brintøkonomiMolekylære modeller, der repræsenterer en 2D-heterostruktur lavet af grafen (sexkantet grå baggrundsgitter), og øer på toppen af sekskantede WS2 og MoS, samt en legering af de to. Vand (H2O) molekyl
Lavpris, skalerbar vandspaltning giver næring til fremtidens brintøkonomiMolekylære modeller, der repræsenterer en 2D-heterostruktur lavet af grafen (sexkantet grå baggrundsgitter), og øer på toppen af sekskantede WS2 og MoS, samt en legering af de to. Vand (H2O) molekyl -
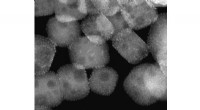 Forvandling af plastikaffald til smøreolieElektronmikrofotografi af platinnanopartiklerne fordelt på perovskit nanorør. Kredit:Northwestern University/Argonne National Laboratory/Ames Laboratory Engangsplast kan have mere iboende værdi, e
Forvandling af plastikaffald til smøreolieElektronmikrofotografi af platinnanopartiklerne fordelt på perovskit nanorør. Kredit:Northwestern University/Argonne National Laboratory/Ames Laboratory Engangsplast kan have mere iboende værdi, e -
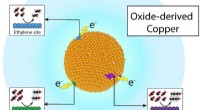 Kulbrændstoffer bliver grønne for vedvarende energiForskere ved Berkeley Lab og Joint Center for Artificial Photosynthesis har vist, at genanvendelse af kuldioxid til værdifulde kemikalier, såsom ethylen og propanol, og brændstoffer som ethanol, kan v
Kulbrændstoffer bliver grønne for vedvarende energiForskere ved Berkeley Lab og Joint Center for Artificial Photosynthesis har vist, at genanvendelse af kuldioxid til værdifulde kemikalier, såsom ethylen og propanol, og brændstoffer som ethanol, kan v
- Hvordan ser det ud til, at en konstellation ser ud til at ændre sig om natten?
- Tre måder, hvorpå big data afslører, hvad du virkelig kan lide at se, læse og lytte til
- Britiske fængsler er ved et bristepunkt – her er hvordan hollænderne halverede deres fængselsbefo…
- Hvad er navnet på processen, hvor en solid ændrer sig direkte til gas?
- Hvilken af disse er den korrekte formel for ammoniumion?
- Hvad er entropi af en solid baseret på?


