Hvilke to tilstande kan begrænse nytten af kinetisk-molekylær teori til at beskrive gasadfærd?
Her er to tilstande, der kan begrænse nytten af kinetisk-molekylær teori:
1. højt tryk: Teorien antager ubetydelig volumen af gasmolekyler sammenlignet med containervolumen. Ved højt tryk pakkes molekyler tættere sammen, og deres volumen bliver en mere markant faktor, hvilket fører til afvigelser fra ideel gasadfærd.
2. Lav temperatur: Teorien antager, at gasmolekyler har ubetydelige intermolekylære kræfter. Ved lave temperaturer bevæger molekyler sig langsommere, og intermolekylære kræfter bliver mere markante. Disse kræfter kan forårsage afvigelser fra ideel gasadfærd, såsom kondens.
Vigtig note: Mens disse forhold begrænser teoriens nøjagtighed, er det stadig et kraftfuldt værktøj til at forstå og forudsige gassens opførsel i mange situationer. Det giver en grundlæggende ramme for at forstå forholdet mellem makroskopiske egenskaber (tryk, volumen, temperatur) og mikroskopiske egenskaber (molekylær bevægelse, intermolekylære kræfter).
Sidste artikelEr Bakelite er en dirigent eller isolator?
Næste artikelHvorfor udsendes gasser?
 Varme artikler
Varme artikler
-
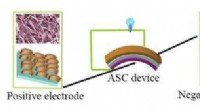 FeCo-selenid - et muligt næste generations materiale til energilagringsenhederDet skematiske fremstillingsdiagram af FeCo-selenid//Fe 2 O 3 asymmetrisk superkondensator (ASC). FeCo-seleniden og Fe 2 O 3 elektroder fungerer som henholdsvis positive og negative elektroder
FeCo-selenid - et muligt næste generations materiale til energilagringsenhederDet skematiske fremstillingsdiagram af FeCo-selenid//Fe 2 O 3 asymmetrisk superkondensator (ASC). FeCo-seleniden og Fe 2 O 3 elektroder fungerer som henholdsvis positive og negative elektroder -
 Et skridt nærmere biotekniske erstatninger for skibe og kanalerKredit:CC0 Public Domain Et team af forskere fra Brigham og Womens Hospital har udviklet en måde at bioprinte rørformede strukturer på, der bedre efterligner oprindelige kar og kanaler i kroppen.
Et skridt nærmere biotekniske erstatninger for skibe og kanalerKredit:CC0 Public Domain Et team af forskere fra Brigham og Womens Hospital har udviklet en måde at bioprinte rørformede strukturer på, der bedre efterligner oprindelige kar og kanaler i kroppen. -
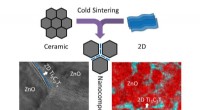 Sintring af atomisk tynde materialer med keramik nu muligtDen skematiske illustration, der viser co-sintring af keramik og 2-D materialer ved hjælp af kold sintringsbehandling, og TEM-billede og energidispersiv spektroskopi (EDS) kort over koldsintret 99ZnO-
Sintring af atomisk tynde materialer med keramik nu muligtDen skematiske illustration, der viser co-sintring af keramik og 2-D materialer ved hjælp af kold sintringsbehandling, og TEM-billede og energidispersiv spektroskopi (EDS) kort over koldsintret 99ZnO- -
 Selvkomprimerende beton bliver mere bæredygtig takket være at bruge granitresterEn UCO-undersøgelse beviser muligheden for at erstatte op til 40% af konventionelle tilslag af selvkomprimerende mørtel med granitslam, dermed reducere byggesektorens miljøbelastning. Kredit:Universit
Selvkomprimerende beton bliver mere bæredygtig takket være at bruge granitresterEn UCO-undersøgelse beviser muligheden for at erstatte op til 40% af konventionelle tilslag af selvkomprimerende mørtel med granitslam, dermed reducere byggesektorens miljøbelastning. Kredit:Universit
- Væske-væske faseadskillelse fundet at drive processen med at konvertere spidroin-proteiner til edd…
- Kraftigt lys gør det muligt for forskere at se knogle såvel som væv
- Hvad er udvindet i Haiti?
- Hvad er citatet no physics life?
- Thailand for at få det til at regne, da forurening kvæler Bangkok
- Kina skal rekruttere civile astronauter, boost bemandede missioner


