Hvad er tætheden af nitrogen ved 100 psi?
Her er hvorfor:
* densitet er en funktion af både tryk og temperatur. Jo højere tryk, jo flere molekyler pakkes i et givet volumen, hvilket øger densiteten. Tilsvarende får højere temperatur molekyler til at bevæge sig hurtigere og sprede sig, hvilket falder tæthed.
* den ideelle gaslov: Denne grundlæggende lov vedrører tryk (P), volumen (V), temperatur (T) og antallet af mol (N) af en gas gennem ligningen:PV =NRT, hvor R er den ideelle gaskonstant.
* densitet (ρ) beregnes som masse (m) pr. Enhedsvolumen (v): ρ =m/v.
For at beregne nitrogenets densitet ved 100 psi skal du kende temperaturen:
1. Konverter pres til atmosfærer: 100 psi er cirka 6,8 atmosfærer (1 atm =14,7 psi).
2. Brug den ideelle gaslov til at finde det molære volumen: Du skal omarrangere ligningen for at løse for V/N.
3. Beregn densiteten: Ved hjælp af den molære volumen og den molære masse af nitrogen (28 g/mol) kan du beregne densiteten.
Eksempel:
Lad os sige, at temperaturen er 25 ° C (298 K):
1. Konverter temperatur til Kelvin: T =25 ° C + 273,15 =298 K.
2. Beregn molvolumen: Ved hjælp af den ideelle gaslov, v/n =rt/p =(0,0821 l⋅ATM/mol⋅k) (298 K)/(6,8 atm) ≈ 3,6 l/mol.
3. Beregn densitet: ρ =(28 g/mol)/(3,6 l/mol) ≈ 7,8 g/l.
Derfor er tætheden af nitrogen ved 100 psi og 25 ° C ca. 7,8 g/l.
 Varme artikler
Varme artikler
-
 Et stort skridt fremad inden for organisk elektronikVerdens første komplementære elektrokemiske logiske kredsløb. Kredit:Thor Balkhed Forskere ved Laboratory of Organic Electronics, Linköpings universitet, har udviklet verdens første komplementære
Et stort skridt fremad inden for organisk elektronikVerdens første komplementære elektrokemiske logiske kredsløb. Kredit:Thor Balkhed Forskere ved Laboratory of Organic Electronics, Linköpings universitet, har udviklet verdens første komplementære -
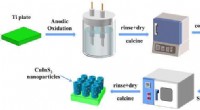 CuInS2/TiO2-fotoanodekompositter klarer sig godt i foto-induceret katodisk beskyttelseGrafisk abstrakt. Kredit:Journal of Materials Science &Technology (2022). DOI:10.1016/j.jmst.2022.02.011 Fotogenereret katodisk beskyttelsesteknologi som en værdifuld gren af fotokatalyse og foto
CuInS2/TiO2-fotoanodekompositter klarer sig godt i foto-induceret katodisk beskyttelseGrafisk abstrakt. Kredit:Journal of Materials Science &Technology (2022). DOI:10.1016/j.jmst.2022.02.011 Fotogenereret katodisk beskyttelsesteknologi som en værdifuld gren af fotokatalyse og foto -
 Silkemikrokokoner kunne bruges i bioteknologi og medicinSilkeormen spinder en silkekokon rundt om sig selv for at beskytte sig under metamorfosen. Forskere har fundet ud af, at silke kan beskytte andre dyrebare laster. Kredit:2017 Natural Materials Group
Silkemikrokokoner kunne bruges i bioteknologi og medicinSilkeormen spinder en silkekokon rundt om sig selv for at beskytte sig under metamorfosen. Forskere har fundet ud af, at silke kan beskytte andre dyrebare laster. Kredit:2017 Natural Materials Group -
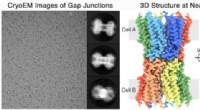 At låse op for hemmelighederne om, hvordan celler kommunikerer, giver indsigt i behandling af sygdo…2-D billeder, venstre, og 3D-strukturen, ret, af gap junction kommunikationskanalen fra øjenlinsen, løst til nær-atomisk opløsning af Reichow Lab ved hjælp af kryo-elektronmikroskopi Kredit:Reichow La
At låse op for hemmelighederne om, hvordan celler kommunikerer, giver indsigt i behandling af sygdo…2-D billeder, venstre, og 3D-strukturen, ret, af gap junction kommunikationskanalen fra øjenlinsen, løst til nær-atomisk opløsning af Reichow Lab ved hjælp af kryo-elektronmikroskopi Kredit:Reichow La
- Hvad syntes folk om jordstrukturen?
- Hær presser på for højere hastigheder i fremtidige tiltrotorfly
- Hvilket atom i sin ubundne tilstand har fire valentelektroner, disse let danner enkelt dobbelt og en…
- Rapportér identificerede nøglesårbarheder to år før cyberangreb på LA Unified
- Gær spotlights genetiske variationer forbinder med lægemiddelresistens
- Hvilke oplysninger giver fri energi om reaktion?


