Hvordan adskiller Bohr -modellen og kvantemekanisk af atom sig, hvordan de beskriver elektroner?
Bohr Model:
* Elektronkrav: Elektroner forestilles som kredsende kernen i specifikke, kvantiserede cirkulære baner, svarende til planeter, der kredser om solen. Hver bane har et fast energiniveau, og elektroner kan kun hoppe mellem disse niveauer ved at absorbere eller udsende specifikke mængder energi.
* Begrænset energiniveau: Elektroner kan kun eksistere i specifikke energiniveauer, og overgange mellem disse niveauer er pludselig og kvantiserede. Dette forklarer emissionsspektre for atomer, hvor kun visse bølgelængder af lys observeres.
* Klassisk fysik: Bohr -modellen indeholder klassiske fysikkoncepter som cirkulære kredsløb og energibesparelse, men introducerer kvantiseringen af energi til at forklare atomfænomener.
kvantemekanisk model:
* Elektronskyer: Elektroner beskrives som eksisterende i sandsynlighedsskyer kaldet orbitaler, som repræsenterer sandsynligheden for at finde et elektron på et givet sted.
* bølgepartikel dualitet: Elektroner udviser både bølge-lignende og partikellignende egenskaber. Deres bevægelse er beskrevet af bølgefunktioner, der bestemmer sandsynligheden for at finde et elektron på et givet punkt i rummet.
* Energiniveauer og subles: Elektroner kan besætte en række energiniveauer og underniveauer inden for et atom, hvor hvert niveau og under niveau har et unikt sæt kvantetal.
* Ingen specifikke stier: Elektroner følger ikke specifikke stier omkring kernen, men besætter snarere en region af rum, der er defineret af sandsynligheden for at finde dem der.
Nøgleforskelle:
| Funktion | Bohr Model | Kvantemekanisk model |
| --- | --- | --- |
| Elektronbeskrivelse | Orbiting partikler i specifikke cirkulære stier | Sandsynlighedsskyer (orbitaler), der repræsenterer elektronplacering |
| Energiniveau | Diskret og kvantiseret | Kontinuerligt interval af energiniveau og underniveauer |
| Elektronbevægelse | Definerede kredsløb omkring kernen | Bølglignende opførsel, ingen specifikke stier |
| Klassisk fysik | Inkorporeret | Erstattet af kvantemekanik |
| Nøjagtighed | Begrænset til hydrogenlignende atomer | Mere nøjagtig for alle atomer |
Kortfattet:
* Bohr -modellen giver et forenklet, intuitivt billede af atomet, men er kun nøjagtigt til enkle systemer som brint.
* Den kvantemekaniske model giver en mere nøjagtig og komplet beskrivelse af atomstruktur, der tegner sig for bølgepartikel-dualiteten af elektroner og den sandsynlige karakter af elektronopførsel.
Mens BoHR -modellen var et afgørende skridt i vores forståelse af atomer, er den kvantemekaniske model den mere sofistikerede og nøjagtige rammer, der bruges til at beskrive opførelsen af elektroner i moderne fysik.
Sidste artikelEr brintgas tættere end luft?
Næste artikelHvilken model skal forskere os til at studere atomer?
 Varme artikler
Varme artikler
-
 Maskinlæring tilbyder en ny måde at designe kirale krystaller påFor at bygge en chiral magnet (billedet), det er nødvendigt først at designe en chiral krystal. Kredit:Julien Zaccaro / Center for Chiral Science Ingeniører og kemikere ved Hiroshima University ha
Maskinlæring tilbyder en ny måde at designe kirale krystaller påFor at bygge en chiral magnet (billedet), det er nødvendigt først at designe en chiral krystal. Kredit:Julien Zaccaro / Center for Chiral Science Ingeniører og kemikere ved Hiroshima University ha -
 Plasmaprotein kan holde løfte om sårstilladserKredit:CC0 Public Domain Forskere i Tyskland har ansat et plasmaprotein, der findes i blod, til at udvikle en ny metode til fremstilling af sårhelende vævsstilladser. Teamets nye stillads kan fas
Plasmaprotein kan holde løfte om sårstilladserKredit:CC0 Public Domain Forskere i Tyskland har ansat et plasmaprotein, der findes i blod, til at udvikle en ny metode til fremstilling af sårhelende vævsstilladser. Teamets nye stillads kan fas -
 Klar, ledende belægning kunne beskytte avancerede solceller, berøringsskærmeSkematisk illustration af PEDOT-syntese ved oCVD-metoden. (A) Det sure skylletrin efter afsætning (f.eks. MeOH eller HBr skylning) bruges generelt til poly(3, 4-ethylen dioxythiophene) (PEDOT) film dy
Klar, ledende belægning kunne beskytte avancerede solceller, berøringsskærmeSkematisk illustration af PEDOT-syntese ved oCVD-metoden. (A) Det sure skylletrin efter afsætning (f.eks. MeOH eller HBr skylning) bruges generelt til poly(3, 4-ethylen dioxythiophene) (PEDOT) film dy -
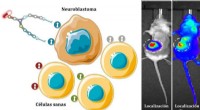 Syntetiske molekyler leverer lægemidler direkte til neuroblastomcellerKredit:Angewandte Chemie-International Edition 58 (2019) Forskere fra Universidad Politécnica de Madrid er involveret i udviklingen af specifikke molekylære stilladser, som er i stand til at lev
Syntetiske molekyler leverer lægemidler direkte til neuroblastomcellerKredit:Angewandte Chemie-International Edition 58 (2019) Forskere fra Universidad Politécnica de Madrid er involveret i udviklingen af specifikke molekylære stilladser, som er i stand til at lev
- Hvad er bevægelsen af varme mellem genstande, der berører hinanden kaldes?
- Hvad kaldes en uddød vulkan?
- Hvad p er et materiale, der ikke lader varme flyde gennem det let?
- Klimamønstre i det nordlige Stillehav påvirker El Nino-forekomster
- Hvor mange mol iltatomer er til stede i 5,00 mol diphosphor pentoxid p2O5?
- Når tyngdekraften trækker sol og måne delvist annullerer hinanden ude af jorden, hvad oplever hva…


