Hvilken model skal forskere os til at studere atomer?
1. Bohr -modellen: Denne model er en enkel og visuel repræsentation af atomet, der viser kernen som en central sfære med elektroner, der kredser rundt om det i specifikke, cirkulære energiniveauer. Mens det nøjagtigt forklarer linjespektre for brint, er det begrænset i sin nøjagtighed for multi-elektronatomer.
2. Den kvantemekaniske model: Dette er den mest moderne og nøjagtige model af atomet. Den beskriver opførslen af elektroner som bølgelignende partikler, der findes i orbitaler (rumområder, hvor der er stor sandsynlighed for at finde et elektron). Det er mere kompliceret end BoHR -modellen, men giver et mere nøjagtigt billede af atomets struktur og egenskaber.
3. Elektronskymodellen: Dette er en forenklet repræsentation af den kvantemekaniske model. Det skildrer elektroner som en uklar sky, der omgiver kernen, med tættere regioner, der indikerer en større sandsynlighed for at finde et elektron.
4. Den faste sfæremodel: Dette er den tidligste model af atomet, foreslået af John Dalton. Det afbildede atomet som en solid, udelelig sfære. Mens det er forældet, er det historisk betydningsfuldt og lagt grundlaget for fremtidige atommodeller.
5. Plum Pudding -modellen: Foreslået af J.J. Thomson, denne model afbildede atomet som en sfære med positiv ladning med negativt ladede elektroner indlejret i den, som blommer i en budding.
6. Beregningsmodeller: Foruden ovenstående bruger forskere også computersimuleringer og beregningsmodeller til at studere atomernes opførsel. Disse modeller kan bruges til at forudsige og forklare egenskaberne for atomer og molekyler og til at designe nye materialer.
Den anvendte specifikke model afhænger af det specifikke aspekt af det atom, der undersøges. For eksempel er BOHR -modellen nyttig til at forklare den grundlæggende struktur af et atom, mens den kvantemekaniske model er nødvendig for at forstå den mere komplekse opførsel af elektroner.
 Varme artikler
Varme artikler
-
 Finjustering af termoelektriske materialer til billigere vedvarende energiKredit:CC0 Public Domain Forskere fra Queen Mary University of London har udviklet nye termoelektriske materialer, som kunne give en billig mulighed for at omdanne varmeenergi til elektricitet. M
Finjustering af termoelektriske materialer til billigere vedvarende energiKredit:CC0 Public Domain Forskere fra Queen Mary University of London har udviklet nye termoelektriske materialer, som kunne give en billig mulighed for at omdanne varmeenergi til elektricitet. M -
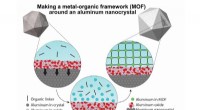 Forskere tilføjer porøs konvolut til aluminium plasmonicsEn grafik, der illustrerer syntesemetoden, der begynder med oxiddækkede aluminiumsnanokrystaller (øverst til venstre) og slutter med nanokrystallen indkapslet i metal-organisk ramme (MOF). MOFen samle
Forskere tilføjer porøs konvolut til aluminium plasmonicsEn grafik, der illustrerer syntesemetoden, der begynder med oxiddækkede aluminiumsnanokrystaller (øverst til venstre) og slutter med nanokrystallen indkapslet i metal-organisk ramme (MOF). MOFen samle -
 Ny hybrid 3D-printteknik vil tilføje en fjerde dimension til additiv fremstillingGrafisk abstrakt. Kredit:DOI:10.1016/j.addma.2021.102337 En ny kemisk proces til additiv fremstilling antyder spændende muligheder for 4D-printede komponenter – såsom egenskaber, der ændrer sig ov
Ny hybrid 3D-printteknik vil tilføje en fjerde dimension til additiv fremstillingGrafisk abstrakt. Kredit:DOI:10.1016/j.addma.2021.102337 En ny kemisk proces til additiv fremstilling antyder spændende muligheder for 4D-printede komponenter – såsom egenskaber, der ændrer sig ov -
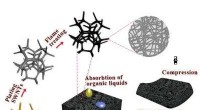 Fremstillingsmetode i stor skala med SWNT -svampe af høj kvalitet3D carbon nanorørsvampen fremstillet ved superhurtig flammebrændingsmetode. Kredit:Shihong Yue I et papir udgivet i Nano , en gruppe forskere rapporterer om at udvikle en simpel flammebrændingsm
Fremstillingsmetode i stor skala med SWNT -svampe af høj kvalitet3D carbon nanorørsvampen fremstillet ved superhurtig flammebrændingsmetode. Kredit:Shihong Yue I et papir udgivet i Nano , en gruppe forskere rapporterer om at udvikle en simpel flammebrændingsm
- I Brasilien håber man at bruge kunstig intelligens til at redde dyrelivet fra skæbne, der dræber …
- Hvilken slags forurening er på en forskningslaboratorium, som er uforsigtigt at hælde kulturer lev…
- Den farlige orkan Willa lukker sig til Mexico
- Videnskabeligt navn for en kønscelle?
- Amerikanske fremskrivninger om den tørkeramte Colorado-flod bliver mere alvorlige
- Hvad er ringplaneterne?


