Hvad er delokaliserede valenselektroner?
delokaliserede valenselektroner:Deling af rigdom
Delokaliserede valenselektroner er dem, der er ikke begrænset til et enkelt atom eller binding men er deles over flere atomer i et molekyle eller et fast stof. De er vigtige for forståelsen af binding og egenskaber i mange molekyler og materialer.
Her er en sammenbrud:
* Valenselektroner: Dette er elektronerne i det yderste energiniveau af et atom, der er involveret i kemisk binding.
* delokalisering: Dette henviser til spredningen ud af elektroner over et større rumområde snarere end at være lokaliseret mellem to specifikke atomer.
Hvordan sker delokalisering?
Delokalisering sker i molekyler eller materialer, der har:
* Flere obligationer: Ligesom dobbelt- eller tredobbeltbindinger, hvor elektroner ikke er begrænset til en enkelt binding, men deles over hele obligationsregionen.
* Resonansstrukturer: Molekyler kan have flere gyldige Lewis -strukturer, hvor elektroner delokaliseres over forskellige atomer.
* Metallisk binding: I metaller er elektroner frie til at bevæge sig gennem hele strukturen og bidrager til deres høje ledningsevne.
Hvad er virkningerne af delokalisering?
Delokaliserede elektroner har flere vigtige konsekvenser:
* Øget stabilitet: Elektronerne er spredt over et større område, hvilket reducerer elektronelektron-frastødning og øger molekylets den samlede stabilitet.
* Forbedret reaktivitet: Delokaliserede elektroner kan deltage lettere i reaktioner, hvilket fører til øget reaktivitet.
* Unikke egenskaber: Delokalisering kan føre til forskellige interessante egenskaber som:
* Farve: Molekyler med delokaliserede elektroner absorberer ofte specifikke bølgelængder af lys, hvilket resulterer i farve.
* Konduktivitet: I metaller giver delokaliserede elektroner mulighed for strøm af elektrisk strøm.
* Magnetiske egenskaber: Nogle materialer med delokaliserede elektroner udviser magnetiske egenskaber.
Eksempler på delokalisering:
* benzen: De seks PI -elektroner i benzen delokaliseres over hele ringen, hvilket fører til dens aromatiske stabilitet og karakteristiske egenskaber.
* grafit: I grafit delokaliseres PI -elektronerne over hele pladen af carbonatomer, hvilket giver det fremragende ledningsevne.
* Metaller: Valenselektronerne i metaller delokaliseres i hele det metalliske gitter og bidrager til deres formbarhed, duktilitet og ledningsevne.
I det væsentlige er delokaliserede valenselektroner som en delt ressource, hvilket fører til forbedret stabilitet, reaktivitet og unikke egenskaber. De spiller en afgørende rolle i bestemmelsen af opførelsen af mange molekyler og materialer.
Sidste artikelHvad ville øge temperaturen på et stof?
Næste artikelGiv en brug af termisk ekspansion i gasser?
 Varme artikler
Varme artikler
-
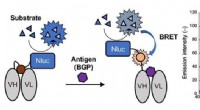 Nyt lys:En ny type immunosensor til immunoassay-testsEnzymet Nluc tilsættes til Q-legemet og danner et Bret Q-legeme. Luminescens observeres ved antigenbinding. Til højre, emissionsspektre i nærvær af substratet af BRET-Q-legemet mærket med det fluoresc
Nyt lys:En ny type immunosensor til immunoassay-testsEnzymet Nluc tilsættes til Q-legemet og danner et Bret Q-legeme. Luminescens observeres ved antigenbinding. Til højre, emissionsspektre i nærvær af substratet af BRET-Q-legemet mærket med det fluoresc -
 At se kemiske reaktioner med musik(Top) Lydkontrollerede spatiotemporale mønstre. Skematisk repræsentation af eksperimentel opsætning brugt til lydstyret spatiotemporal mønstergenerering. For mønstergenereringseksperimenter, O2-følsom
At se kemiske reaktioner med musik(Top) Lydkontrollerede spatiotemporale mønstre. Skematisk repræsentation af eksperimentel opsætning brugt til lydstyret spatiotemporal mønstergenerering. For mønstergenereringseksperimenter, O2-følsom -
 Smedning af molekylære bindinger med grønt lysKredit:Queensland University of Technology (QUT) QUT-forskere har skabt et nyt molekylært koblingsværktøj, der anvender både grønt lys og pH-triggere, der har potentiale til brug i applikationer s
Smedning af molekylære bindinger med grønt lysKredit:Queensland University of Technology (QUT) QUT-forskere har skabt et nyt molekylært koblingsværktøj, der anvender både grønt lys og pH-triggere, der har potentiale til brug i applikationer s -
 Kubeformede jern-svovl-klynger understøtter multiple bindinger mellem jern og nitrogenKredit:Wiley I en række biologiske processer, jern-svovlklynger spiller en afgørende rolle, hvor de fungerer som cofaktorer til enzymer. Forskning offentliggjort i Angewandte Chemie viser nu, at
Kubeformede jern-svovl-klynger understøtter multiple bindinger mellem jern og nitrogenKredit:Wiley I en række biologiske processer, jern-svovlklynger spiller en afgørende rolle, hvor de fungerer som cofaktorer til enzymer. Forskning offentliggjort i Angewandte Chemie viser nu, at


