Har kobber II -sulfat et højt smeltepunkt?
Her er hvorfor:
* ionisk forbindelse: Kobber (II) sulfat er en ionisk forbindelse, hvilket betyder, at det dannes af den elektrostatiske tiltrækning mellem positivt ladede kobberioner (Cu²⁺) og negativt ladede sulfationer (SO₄²⁻). Disse stærke elektrostatiske kræfter kræver en masse energi til at overvinde, hvilket fører til høje smeltepunkter.
* stærk gitterstruktur: De ioniske bindinger i kobber (II) sulfat skaber en stiv krystalgitterstruktur. Denne struktur kræver betydelig energi til at bryde fra hinanden, hvilket yderligere bidrager til det høje smeltepunkt.
smeltepunkt for kobber (II) sulfat:
* vandfri cuso₄: 560 ° C (1040 ° F)
* hydreret cuso₄ · 5H₂O (kobber (II) sulfatpentahydrat): 110 ° C (230 ° F)
Som du kan se, har den vandfri form et meget højere smeltepunkt end den hydratiserede form. Dette skyldes, at vandmolekylerne i den hydratiserede form forstyrrer gitterstrukturen og svækker de ioniske bindinger.
Derfor har kobber (II) sulfat faktisk et højt smeltepunkt, især i sin vandfri form.
Sidste artikelHvor mange molekyler er i 5,23 gram C6H6?
Næste artikelHvad bevæger sig rundt i atomets kerne?
 Varme artikler
Varme artikler
-
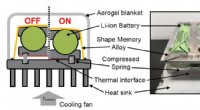 Termiske høreværn beskytter mobiltelefonens batterier mod ekstreme temperaturerDer vises en skematisk og foto af en termisk regulator designet af Berkeley-ingeniører til passivt at holde lithium-ion-batterier inden for et optimalt temperaturområde. Ved højere temperaturer, ledni
Termiske høreværn beskytter mobiltelefonens batterier mod ekstreme temperaturerDer vises en skematisk og foto af en termisk regulator designet af Berkeley-ingeniører til passivt at holde lithium-ion-batterier inden for et optimalt temperaturområde. Ved højere temperaturer, ledni -
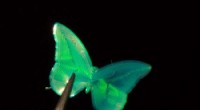 En ny flydende krystal blæk til 3D-printKredit:Eindhoven University of Technology Kolesteriske flydende krystaller, et menneskeskabt materiale med egenskaber mellem væsker og faste krystaller, kan efterligne farverne på sommerfuglevinge
En ny flydende krystal blæk til 3D-printKredit:Eindhoven University of Technology Kolesteriske flydende krystaller, et menneskeskabt materiale med egenskaber mellem væsker og faste krystaller, kan efterligne farverne på sommerfuglevinge -
 Forskere ser på olie og vand interaktion for at forhindre vandforureningKredit:Jim Young, UIC Olieudslip i havet har en ødelæggende indvirkning på miljøet. Mere end 400, 000 liter olie spildes i havene hvert år, påvirker hundredvis af kvadratkilometer og dræber mere e
Forskere ser på olie og vand interaktion for at forhindre vandforureningKredit:Jim Young, UIC Olieudslip i havet har en ødelæggende indvirkning på miljøet. Mere end 400, 000 liter olie spildes i havene hvert år, påvirker hundredvis af kvadratkilometer og dræber mere e -
 Detaljeret billede afslører, hvordan tandemaljen er stærk nok til at holde livet udPIC -kortlægning, som måler biominerale krystalorienteringer og tildeler forskellige farver til forskellige rotationsvinkler, afslører, at krystallerne i tandemaljen ikke er perfekt justeret. Kredit:P
Detaljeret billede afslører, hvordan tandemaljen er stærk nok til at holde livet udPIC -kortlægning, som måler biominerale krystalorienteringer og tildeler forskellige farver til forskellige rotationsvinkler, afslører, at krystallerne i tandemaljen ikke er perfekt justeret. Kredit:P
- Hvor mange zinkatomer er til stede i 20,0 g Zn?
- Hvad bevæger Højesterets 'sving'-dommere?
- Hvad er svaghederne ved svovl?
- Hvordan bruges mekanisk energi i fremtiden?
- Hvilken type bølge rejser bu skubber og trækker på stof?
- Små materialer kan være nøglen til at reducere dødsfald ved hjerte-kar-sygdomme


