Hvad er svaghederne ved svovl?
Kemisk reaktivitet:
* reaktivitet med metaller: Svovl reagerer let med mange metaller for at danne sulfider, hvilket ofte fører til korrosion og nedbrydning.
* reaktivitet med oxidanter: Svovl reagerer let med oxidationsmidler som ilt og danner svovldioxid (SO2), et skadeligt luftforurenende stof.
* ustabil i høje temperaturer: Svovl er brandfarligt og brænder let i luften, hvilket potentielt forårsager brande og eksplosioner.
Fysiske egenskaber:
* Lav smeltnings- og kogepunkter: Svovl smelter ved en relativt lav temperatur (115,21 ° C) og koger ved 444,6 ° C, hvilket gør det vanskeligt at bruge i applikationer med høj temperatur.
* uopløselighed i vand: Svovl er praktisk talt uopløselig i vand, hvilket begrænser brugen i vandige opløsninger.
Miljøovervejelser:
* skadeligt for miljøet: Svovldioxid (SO2), et biprodukt af brændende svovlholdige brændstoffer, bidrager til surt regn og andre miljøproblemer.
* giftige for levende organismer: Svovlforbindelser som hydrogensulfid (H2S) og svovldioxid (SO2) kan være giftigt for planter og dyr.
Ansøgninger og begrænsninger:
* Vulkanisering af gummi: Svovl er afgørende for at vulkanisere gummi, men dets anvendelse kan skabe et potentiale for svovlblomstring (overfladeaflejringer) og nedbrydning over tid.
* Produktion af svovlsyre: Svovl er en nøgleingrediens i produktionen af svovlsyre, et vigtigt industrikemikalie, men selve processen kan være energikrævende og have miljøpåvirkninger.
Det er vigtigt at bemærke, at svovlens "svagheder" er i forhold til dets tilsigtede anvendelse. For eksempel kan dens reaktivitet med metaller være både en ulempe i nogle anvendelser (korrosion) og en fordel i andre (metal sulfidproduktion).
I sidste ende tillader forståelse af svovlens egenskaber dens effektive og sikre anvendelse i forskellige brancher.
 Varme artikler
Varme artikler
-
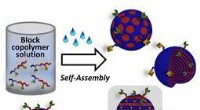 Oprettelse og selektiv funktionalisering af viruslignende polymerpartiklerSkematisk illustration af værket. Kredit:John Wiley &Sons, Inc. Forskere ved Tohoku University i Japan har samarbejdet med andre for at udvikle en enkel måde at skabe og funktionalisere virusligne
Oprettelse og selektiv funktionalisering af viruslignende polymerpartiklerSkematisk illustration af værket. Kredit:John Wiley &Sons, Inc. Forskere ved Tohoku University i Japan har samarbejdet med andre for at udvikle en enkel måde at skabe og funktionalisere virusligne -
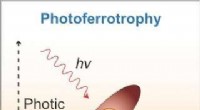 Disse mikrober spiser elektroner til energiFotoferrotrofe organismer bruger lys og elektroner fra miljøet som energikilde. Kredit:Duke Research Blog Den menneskelige krop er befolket af et større antal mikrober end dens egne celler. Disse
Disse mikrober spiser elektroner til energiFotoferrotrofe organismer bruger lys og elektroner fra miljøet som energikilde. Kredit:Duke Research Blog Den menneskelige krop er befolket af et større antal mikrober end dens egne celler. Disse -
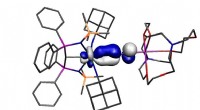 Uran bryder reglerne igenKredit:University of Manchester Arbejde ledet af forskergruppen til professor Steve Liddle og offentliggjort i det prestigefyldte tidsskrift Naturkemi har rapporteret et uranditrogenmolekyle, de
Uran bryder reglerne igenKredit:University of Manchester Arbejde ledet af forskergruppen til professor Steve Liddle og offentliggjort i det prestigefyldte tidsskrift Naturkemi har rapporteret et uranditrogenmolekyle, de -
 Holder knasen i fedtfattige chipsDr. Heather Smyth og professor Jason Stokes holder knasen i fedtfattige kartoffelchips. Kredit:University of Queensland University of Queensland kemiingeniører har udviklet en ny metode til at ana
Holder knasen i fedtfattige chipsDr. Heather Smyth og professor Jason Stokes holder knasen i fedtfattige kartoffelchips. Kredit:University of Queensland University of Queensland kemiingeniører har udviklet en ny metode til at ana
- Sundhedsmæssige virkninger af udbruddet af Nyiragongo vil blive mærket i lang tid
- Genovervejelse af teknologiens rolle i klasseværelset
- Kan supersymmetri og multiverset begge være sande samtidigt?
- Hvad synes jødedommen om organ, der er transporteret?
- Exoplaneter til medicinske tests:Små frekvensapparater åbner nye applikationer
- Hvor mange centimeter i 32 tommer?


