Hvordan handler gaspartikler?
1. Konstant bevægelse:
* høj kinetisk energi: Gaspartikler har en høj mængde kinetisk energi, hvilket betyder, at de bevæger sig meget hurtigt og tilfældigt i alle retninger.
* Kollisioner: De kolliderer konstant med hinanden og med væggene i deres beholder. Disse kollisioner er elastiske, hvilket betyder, at ingen energi går tabt.
2. Svage interaktioner:
* Afstand: Gaspartikler er meget langt fra hinanden sammenlignet med væsker eller faste stoffer, hvilket betyder, at de har meget svagere attraktive kræfter mellem dem.
* ubetydelige intermolekylære kræfter: Kræfterne mellem gaspartikler (van der Waals -styrker) er meget svage og har en minimal indflydelse på deres bevægelse.
3. Kompressibilitet:
* Stor tomt rum: De store afstande mellem partikler betyder, at der er meget tom plads i en gas.
* Komprimering: Gas kan let komprimeres ved at reducere volumenet på dens beholder. Dette tvinger partiklerne tættere sammen.
4. Diffusion:
* Tilfældig bevægelse: Den tilfældige bevægelse af gaspartikler giver dem mulighed for at sprede sig og fylde enhver beholder, de besætter.
* blanding: Når forskellige gasser anbringes i den samme beholder, blander de jævnt på grund af diffusion.
5. Tryk:
* Kollisioner med vægge: De konstante kollisioner af gaspartikler med væggene i deres beholder udøver en kraft, som vi opfatter som pres.
* Faktorer, der påvirker pres: Trykket er direkte proportionalt med temperaturen på gassen og omvendt proportional med beholderens volumen.
her er en simpel analogi: Forestil dig et værelse fuld af ping pong -kugler, der hopper tilfældigt rundt. De kolliderer konstant med hinanden og væggene i rummet. Dette ligner, hvordan gaspartikler opfører sig.
I resuméet er gaspartikler konstant i bevægelse, har svage interaktioner, er meget komprimerbare, diffuse let og udøver pres på deres omgivelser.
 Varme artikler
Varme artikler
-
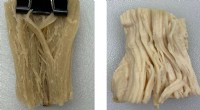 Menneskelige celler optager mindre protein fra plantebaseret kød end fra kyllingEn køderstatning (til venstre) ligner kyllingekød (til højre), men dens proteiner absorberes ikke så godt af menneskeceller. Kredit:Bearbejdet fra Journal of Agricultural and Food Chemistry 2022, DOI:
Menneskelige celler optager mindre protein fra plantebaseret kød end fra kyllingEn køderstatning (til venstre) ligner kyllingekød (til højre), men dens proteiner absorberes ikke så godt af menneskeceller. Kredit:Bearbejdet fra Journal of Agricultural and Food Chemistry 2022, DOI: -
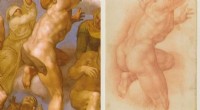 Ny hydrogel udviklet til at fjerne tape fra århundreder gammel tegning(Venstre) Detalje fra Ascesa dei Beati (Michelangelo Buonarroti) fra Det Sixtinske Kapel; (Til højre) tegning fra 1500-tallet, der gengiver den samme detalje. En indskrift di mano di Michelangelo (fra
Ny hydrogel udviklet til at fjerne tape fra århundreder gammel tegning(Venstre) Detalje fra Ascesa dei Beati (Michelangelo Buonarroti) fra Det Sixtinske Kapel; (Til højre) tegning fra 1500-tallet, der gengiver den samme detalje. En indskrift di mano di Michelangelo (fra -
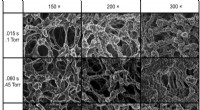 Forskere rapporterer om tosidede Janus-membranapplikationerDisse er overflade-SEM-billeder af Janus-membranfronter dyrket med 150, 200 og 300 cyklusser ved .015, 06 og 0,15 sekunder eksponeringer. En generel tendens til hurtigere nukleering og efterfølgende b
Forskere rapporterer om tosidede Janus-membranapplikationerDisse er overflade-SEM-billeder af Janus-membranfronter dyrket med 150, 200 og 300 cyklusser ved .015, 06 og 0,15 sekunder eksponeringer. En generel tendens til hurtigere nukleering og efterfølgende b -
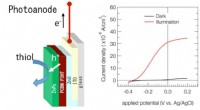 Miljøvenlige elektrokemiske katalysatorer, der bruger solceller til at høste energi fra solenStrukturen af den foreslåede enhed, viser, hvordan de genererede huller (h+) bruges til at lette thioloxidation. Den målte strøm stiger dramatisk under belysning og anvendelse af et lille potentiale
Miljøvenlige elektrokemiske katalysatorer, der bruger solceller til at høste energi fra solenStrukturen af den foreslåede enhed, viser, hvordan de genererede huller (h+) bruges til at lette thioloxidation. Den målte strøm stiger dramatisk under belysning og anvendelse af et lille potentiale
- Hvorfor stiger energien, når spænding øges?
- Er den termiske energi, der strømmer fra et stof til et andet, når stofferne er forskellige i temp…
- Gravitationsbølger opdaget for tredje gang,
- Hvad er empirisk formel for klor og jod?
- Hvilke planeter kan ses med det menneskelige øje?
- At spille spil for at løse bevaringskonflikter


