Hvorfor har gasser ingen bestemt volumen, og de kan komprimeres?
1. Svage intermolekylære kræfter: Gasmolekyler har meget svage intermolekylære kræfter (som van der Waals -styrker), der holder dem sammen. Dette betyder, at de er frie til at bevæge sig rundt og sprede sig og tage formen og volumenet på deres beholder.
2. Store afstande mellem molekyler: Gasmolekyler er langt fra hinanden sammenlignet med væsker og faste stoffer. Dette giver dem mulighed for at bevæge sig frit og fylde den tilgængelige plads.
3. Konstant bevægelse og kollisioner: Gasmolekyler er i konstant tilfældig bevægelse og kolliderer med hinanden og væggene i deres beholder. Denne kontinuerlige bevægelse og kollisioner skaber pres.
4. Kompressibilitet: På grund af de store afstande mellem molekyler og svage kræfter tvinger det molekyler tættere sammen, hvilket reducerer dens volumen. Dette er grunden til, at gasser kan komprimeres.
her er en simpel analogi:
Forestil dig et værelse fuld af mennesker. Hvis folket står langt fra hinanden og bevæger sig frit (som gasmolekyler), kan de let skubbes tættere sammen (komprimeret). Hvis folket er overfyldte og tæt pakket (som flydende molekyler), er de vanskeligere at komprimere.
Nøglepunkter:
* Ingen bestemt bind: Gasser udvides for at fylde deres beholder og påtage sig dens form.
* Kompressibilitet: Gasser kan komprimeres, fordi deres molekyler kan tvinges tættere sammen.
* tryk: Kollisionerne af gasmolekyler mod væggene i deres beholder skaber tryk.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse punkter!
 Varme artikler
Varme artikler
-
 Forskere afslører en køreplan for at hjælpe med udvikling af osteoporosebehandlingFra venstre mod højre:forskningsassistent Ruben Garcia-Ordonez, Forskningsassistent Jie Zheng, Professor Pat Griffin, Forskningsassistent Scott Novick, Stabsforsker Mi Ra Chang. Kredit:Scripps Researc
Forskere afslører en køreplan for at hjælpe med udvikling af osteoporosebehandlingFra venstre mod højre:forskningsassistent Ruben Garcia-Ordonez, Forskningsassistent Jie Zheng, Professor Pat Griffin, Forskningsassistent Scott Novick, Stabsforsker Mi Ra Chang. Kredit:Scripps Researc -
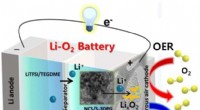 Et frisk pust til længerevarende batterierKatoden er designet til at lette optagelse og frigivelse af ilt, processer, der er nødvendige for afladning og opladning af et litium-luftbatteri. Kredit:DGIST DGIST-forskere forbedrer ydelsen af
Et frisk pust til længerevarende batterierKatoden er designet til at lette optagelse og frigivelse af ilt, processer, der er nødvendige for afladning og opladning af et litium-luftbatteri. Kredit:DGIST DGIST-forskere forbedrer ydelsen af -
 Forskerhold rekonstruerer motor-lastkompleks til ciliær transportDr. Zeynep Oekten og medforfatter Willi L. Stepp ved det fluorescensmikroskop, de bruger til at observere de motoriske proteiner, der løber langs mikrotubulierne (se video). Kredit:Andreas Battenberg
Forskerhold rekonstruerer motor-lastkompleks til ciliær transportDr. Zeynep Oekten og medforfatter Willi L. Stepp ved det fluorescensmikroskop, de bruger til at observere de motoriske proteiner, der løber langs mikrotubulierne (se video). Kredit:Andreas Battenberg -
 Designerbakterier producerer koralantibiotikaHornkoraller af arten Antillogorgia elisabethae producerer antibiotiske naturlige stoffer. Et forskerhold på TUM har med succes produceret et af disse stoffer i laboratoriet. Kredit:Thomas Brück/TUM
Designerbakterier producerer koralantibiotikaHornkoraller af arten Antillogorgia elisabethae producerer antibiotiske naturlige stoffer. Et forskerhold på TUM har med succes produceret et af disse stoffer i laboratoriet. Kredit:Thomas Brück/TUM
- Hvad er den kemiske reaktion med sølvnitrat og jod blandet sammen?
- Hvad er flagella -positionen for Proteus vulgaris?
- Amazon står over for antitrust -sonde over sin markedsplads, siger rapporten
- Hvordan blade taler til rødder
- Hvad er omfanget af ernæring som videnskab?
- Hvordan laver planter ilt? Spørg cyanobakterier


