Den attraktive kraft mellem to kroppe af forskellige stoffer?
Her er en sammenbrud af de typer intermolekylære kræfter:
* van der Waals Forces: Dette er svage kræfter med kort rækkevidde, der opstår fra midlertidige udsving i elektronfordeling omkring molekyler. De er yderligere opdelt i:
* London Dispersion Forces: Til stede i alle molekyler, men stærkere i større molekyler.
* dipol-dipol-kræfter: Forekommer mellem polære molekyler med permanente dipoler.
* Hydrogenbinding: En speciel type dipol-dipolinteraktion, hvor et hydrogenatom er bundet til et stærkt elektronegativt atom (som ilt, nitrogen eller fluor).
* ioniske kræfter: Disse forekommer mellem modsat ladede ioner, som kan være til stede i forskellige stoffer eller inden for det samme stof. De er meget stærkere end van der Waals -styrker.
Styrken af disse intermolekylære kræfter afhænger af flere faktorer, herunder:
* Type kraft: Hydrogenbinding er den stærkeste, efterfulgt af dipol-dipolstyrker og derefter London Dispersion Forces.
* Polaritet af molekylerne: Polære molekyler udviser stærkere intermolekylære kræfter.
* størrelse og form af molekylerne: Større og mere komplekse molekyler har større overfladeareal og derfor stærkere London -spredningskræfter.
Kortfattet:
Den attraktive kraft mellem to kroppe af forskellige stoffer skyldes intermolekylære kræfter, som primært er påvirket af typen af kraft, polaritet af molekylerne og størrelse og form af molekylerne.
Sidste artikelDen proces, der forhindrer, at varmen overføres mellem to stoffer kaldes?
Næste artikelHvordan fungerer en likvidiser?
 Varme artikler
Varme artikler
-
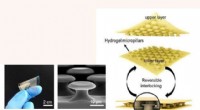 Forskere udvikler en ny klasse af undervandslimFotografi af det fremstillede fleksible sammenklæbende klæbemiddel (til venstre) og et SEM -billede (i midten) af PEGDMA mikrokrogarrays af klæbemidlet. Til højre er den konceptuelle illustration af d
Forskere udvikler en ny klasse af undervandslimFotografi af det fremstillede fleksible sammenklæbende klæbemiddel (til venstre) og et SEM -billede (i midten) af PEGDMA mikrokrogarrays af klæbemidlet. Til højre er den konceptuelle illustration af d -
 Forskere identificerer et molekyle, der kunne have hjulpet celler med at overleve - og trives - på …Protoceller ville have været forfædre til celler i dag, hvis du vil, ” siger Ramanarayanan Krishnamurthy, PhD, en lektor i kemi ved Scripps Research. De havde ikke den fulde funktionalitet af moderne
Forskere identificerer et molekyle, der kunne have hjulpet celler med at overleve - og trives - på …Protoceller ville have været forfædre til celler i dag, hvis du vil, ” siger Ramanarayanan Krishnamurthy, PhD, en lektor i kemi ved Scripps Research. De havde ikke den fulde funktionalitet af moderne -
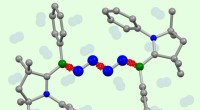 Inert nitrogen tvunget til at reagere med sig selvFor første gang, to molekyler af atmosfærisk nitrogen (blå, midten) er koblet direkte til hinanden i forskning af kemikere fra Würzburg og Frankfurt. Kredit:Dr. Rian Dewhurst / Dr. Marc-André Légaré
Inert nitrogen tvunget til at reagere med sig selvFor første gang, to molekyler af atmosfærisk nitrogen (blå, midten) er koblet direkte til hinanden i forskning af kemikere fra Würzburg og Frankfurt. Kredit:Dr. Rian Dewhurst / Dr. Marc-André Légaré -
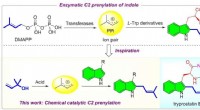 Bioinspireret syrekatalyseret C2-prenylering af indolderivaterBiomimetisk katalyse er et nyt begreb, der efterligner nøglefunktioner i enzymatisk proces. Prenylering er en allestedsnærværende proces, der findes i næsten alle levende organismer. Inspireret af den
Bioinspireret syrekatalyseret C2-prenylering af indolderivaterBiomimetisk katalyse er et nyt begreb, der efterligner nøglefunktioner i enzymatisk proces. Prenylering er en allestedsnærværende proces, der findes i næsten alle levende organismer. Inspireret af den
- Byggematerialer kommer til live med hjælp fra bakterier
- Acceleration på grund af tyngdekraften ved jordoverfladen er?
- Crowdsourced spil har til formål at finde løsninger på aflatoksin
- Smarte transformerbare nanopartikler lover fremskridt inden for tumordiagnoser, behandling
- Hvordan påvirker tykkelsen af lava naturen?
- Hvilken form for energi er repræsenteret af en bog, der ligger på skrivebordet, der falder ned på…


