Hvordan relaterer tryk og antal gasmolekyler?
Her er hvorfor:
* kinetisk molekylær teori: Denne teori beskriver gasadfærd. Den siger, at gasmolekyler konstant er i tilfældig bevægelse, der kolliderer med hinanden og væggene i deres beholder.
* tryk: Tryk er defineret som den kraft, der udøves pr. Enhedsareal. I en gas er denne kraft forårsaget af kollisioner af gasmolekyler med containervæggene.
* flere molekyler, flere kollisioner: Hvis du har flere gasmolekyler i den samme beholder, vil der være flere kollisioner med væggene pr. Tidsenhed. Dette betyder, at der udøves en højere kraft på væggene, hvilket fører til højere tryk.
Tænk på det sådan: Forestil dig et værelse fuld af mennesker. Hvis flere mennesker kommer ind i lokalet, vil der være flere kollisioner mellem mennesker og væggene. Væggene vil føle mere pres på grund af det øgede antal kollisioner.
Matematisk forhold:
Forholdet mellem tryk (p), antallet af mol (n) og volumen (v) af en gas er beskrevet af den ideelle gaslov:
pv =nrt
Hvor:
* R er den ideelle gaskonstant
* T er temperaturen i Kelvin
Denne ligning viser, at tryk (p) er direkte proportionalt med antallet af mol (n) af gas under forudsætning af konstant volumen og temperatur.
Praktiske eksempler:
* oppustning af et dæk: At tilføje mere luft til et dæk øger antallet af gasmolekyler inde, hvilket fører til højere tryk.
* madlavning i en trykkoger: Trykkomfuren fælder damp, hvilket øger antallet af vandmolekyler i beholderen og øger således trykket.
* iltbeholder: En iltbeholder har en høj koncentration af iltmolekyler, hvilket resulterer i højt tryk.
Kortfattet: Det tryk, der udøves af en gas, er direkte proportionalt med antallet af gasmolekyler, der er til stede. Jo flere molekyler, jo flere kollisioner og jo højere er trykket.
 Varme artikler
Varme artikler
-
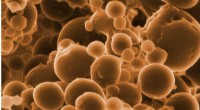 Vidensgab lukket i vores forståelse af nedbrydning af ethanDannelse af små vesikler indikerer, at Candidatus Argoarchaeum ethanivorans deler sig ved knopskydning. Forskerne opdagede disse strukturer med et højopløseligt helium-ionmikroskop. De arkæiske celler
Vidensgab lukket i vores forståelse af nedbrydning af ethanDannelse af små vesikler indikerer, at Candidatus Argoarchaeum ethanivorans deler sig ved knopskydning. Forskerne opdagede disse strukturer med et højopløseligt helium-ionmikroskop. De arkæiske celler -
 Biomimetisk strategi fører til stærke, genanvendeligt gummiKredit:Wiley Inspireret af naturen, Kinesiske videnskabsmænd har fremstillet en syntetisk analog til vulkaniseret naturgummi. Deres materiale er lige så hårdt og holdbart som originalen. I journal
Biomimetisk strategi fører til stærke, genanvendeligt gummiKredit:Wiley Inspireret af naturen, Kinesiske videnskabsmænd har fremstillet en syntetisk analog til vulkaniseret naturgummi. Deres materiale er lige så hårdt og holdbart som originalen. I journal -
 Bipolar orden:En ligetil teknik til at have mere kontrol over organiske tynde filmKombinationen af bipolar elektrokemi med elektrolytisk micelforstyrrelse fører til fremstilling af formede organiske tynde film. Fremgangsmåden indebærer trådløs fremkaldelse af en ønsket potentialf
Bipolar orden:En ligetil teknik til at have mere kontrol over organiske tynde filmKombinationen af bipolar elektrokemi med elektrolytisk micelforstyrrelse fører til fremstilling af formede organiske tynde film. Fremgangsmåden indebærer trådløs fremkaldelse af en ønsket potentialf -
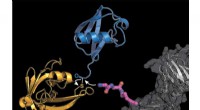 Mærkning af proteiner med ubiquitin baner ny vej til forskning i cellereguleringForskerne udstyrede et cellulært protein (gråt) med en modificeret lysinaminosyre byggesten (lyserød), hvortil det bakterielle enzym sortase (gul) transmitterer et ubiquitinmolekyle (blåt). Kredit:K.
Mærkning af proteiner med ubiquitin baner ny vej til forskning i cellereguleringForskerne udstyrede et cellulært protein (gråt) med en modificeret lysinaminosyre byggesten (lyserød), hvortil det bakterielle enzym sortase (gul) transmitterer et ubiquitinmolekyle (blåt). Kredit:K.
- Friktion fandt, hvor der ikke burde være nogen - i superfluider nær absolut nul
- Forskere opdager stort kryptografisk potentiale i nanomateriale
- Allestedsnærværende marine organismer udviklede sig sammen med andre mikrober, fremme mere komplek…
- Fiberoptisk kabel overvåger mikroseismicitet i Antarktis
- Hvordan produceres naturgas ud fra råolie?
- Hvad bliver trykket, når der påføres en kraft på 30N på et areal på 120 cm kvadrat?


