Mærkning af proteiner med ubiquitin baner ny vej til forskning i celleregulering
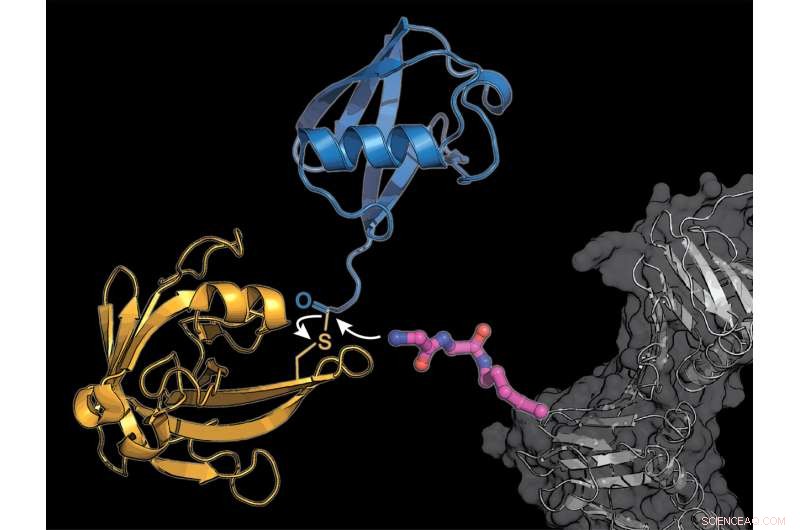
Forskerne udstyrede et cellulært protein (gråt) med en modificeret lysinaminosyre byggesten (lyserød), hvortil det bakterielle enzym sortase (gul) transmitterer et ubiquitinmolekyle (blåt). Kredit:K. Lang / TUM
Menneskelige celler har et sofistikeret reguleringssystem, der består af mærkning af proteiner med det lille molekyle ubiquitin. I det første, et team fra det tekniske universitet i München (TUM) er lykkedes med at markere proteiner med ubiquitin målrettet i reagensglas såvel som i levende celler. Proceduren åbner døren for at udforske det indre arbejde i dette vitale reguleringssystem.
Planter, svampe, dyr og mennesker udtrykker proteinet ubiquitin. Den består af en sekvens på 76 aminosyrer, gør det til et relativt lille biomolekyle. Men dens indflydelse er vidtrækkende:typen, position og antal ubiquitinmolekyler bundet til proteiner bestemmer deres stabilitet, fungere, og placering i cellen.
"Næsten hver proces i cellen påvirkes direkte eller indirekte af ubiquitin. Derfor er fejl i denne mærkningsmekanisme forbundet med udvikling og progression af kræft og mange andre alvorlige sygdomme, "forklarer Kathrin Lang, Professor i syntetisk biokemi ved det tekniske universitet i München.
Opdagelsen af den vigtige rolle, dette cellulære reguleringssystem spiller i den kontrollerede nedbrydning af proteiner, blev anerkendt med Nobelprisen i kemi i 2004. Men, i mange tilfælde er detaljerne om, hvordan ubiquitin -ændringer påvirker cellens funktion, stadig uklare. Kathrin Langs team har nu udviklet en metode til at vedhæfte ubiquitin -etiketter til målrettede proteiner - en nøgle til at udforske systemet.
Et bakterieenzym skaber nye forbindelser
Langs team bruger to tricks til at omgå det komplicerede naturlige system:De indeholder en ny modificeret aminosyre, hvor den bakterie-afledte enzymsortase kan vedhæfte ubiquitin eller et ubiquitin-lignende molekyle.

Første forfatter Maximilian Fottner og prof. Kathrin Lang i deres laboratorium. Kredit:Andreas Battenberg / TUM
"Den største udfordring var at tilpasse de forskellige trin - inkorporering af den unaturlige aminosyre i et målprotein og overførsel af ubiquitin med enzymet sortase - på en sådan måde, at de ikke kun fungerer i reagensglasset, men også i livet celler, "minder Maximilian Fottner, undersøgelsens hovedforfatter.
I mellemtiden, forskerne ved det tekniske universitet i München har optimeret og patenteret deres nye metode til mange forskellige cellulære proteiner. "Vi har allerede indgået samarbejde med læger og cellebiologer, der nu ønsker at samarbejde med os om at undersøge effekterne af ubiquitinmarkører på udviklingen af kræft og neurodegenerative sygdomme som Parkinsons på molekylært niveau, "siger professor Lang.
 Varme artikler
Varme artikler
-
 Ny teknologi omdanner biomasse til kulKredit:University of Nottingham University of Nottingham samarbejder med Energy Research Accelerator (ERA) og CPL Industries om at producere en kommerciel anlæg, der er i stand til at omdanne biom
Ny teknologi omdanner biomasse til kulKredit:University of Nottingham University of Nottingham samarbejder med Energy Research Accelerator (ERA) og CPL Industries om at producere en kommerciel anlæg, der er i stand til at omdanne biom -
 Forskere opdager protonregulator af essentielt kræftmicroRNAKredit:CC0 Public Domain MicroRNAer (miRNAer) er evolutionært bevarede små ikke -kodende RNAer - bits af genetisk kode, der fungerer som kritiske genregulatorer i mange aspekter af biologiske proc
Forskere opdager protonregulator af essentielt kræftmicroRNAKredit:CC0 Public Domain MicroRNAer (miRNAer) er evolutionært bevarede små ikke -kodende RNAer - bits af genetisk kode, der fungerer som kritiske genregulatorer i mange aspekter af biologiske proc -
 Materiale dannet af krabbeskaller og træer kunne erstatte fleksibel plastemballageJ. Carson Meredith, en professor ved Georgia Techs School of Chemical and Biomolecular Engineering, rummer det nye emballagemateriale fremstillet af krabbeskalsindhentet kitin og cellulose fra træfibr
Materiale dannet af krabbeskaller og træer kunne erstatte fleksibel plastemballageJ. Carson Meredith, en professor ved Georgia Techs School of Chemical and Biomolecular Engineering, rummer det nye emballagemateriale fremstillet af krabbeskalsindhentet kitin og cellulose fra træfibr -
 Video:Jordens små skraldefolk?Kredit:The American Chemical Society Hvis du nyder noget velsmagende mad i dag, der har mindst én ingrediens, der blev dyrket et sted, du skylder sandsynligvis lidt takket være regnorme. Hvordan
Video:Jordens små skraldefolk?Kredit:The American Chemical Society Hvis du nyder noget velsmagende mad i dag, der har mindst én ingrediens, der blev dyrket et sted, du skylder sandsynligvis lidt takket være regnorme. Hvordan
- Buzz Aldrin hylder verdensikonet John Glenn
- Udryddelse er for evigt - og økosystemgendannelse kræver en virkelig, rigtig lang tid
- Komprimeret sensing muliggør mikroskopi med superopløsning af levende cellestrukturer
- At undervise børn, der ikke har brug for det, er en blomstrende forretning i velhavende områder
- Lu fratræden et slag for Baidus-skub ind i AI, siger analytikere
- Mikrober, der lever af metan, frigiver arsen til grundvandet


