Modellering af biomimetiske kollagen-ligand-interaktioner for at forstå intrafibrillær mineralisering
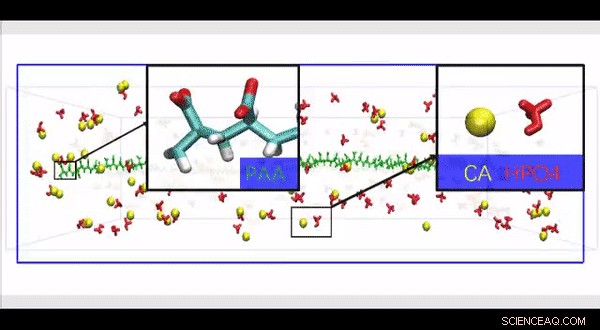
Fuld atomistisk molekylær dynamiksimulering af en højopløselig HPAA-kollagenstruktur konstrueret til at undersøge effekten af tilstedeværelsen af store polyelektrolytmolekyler langs overfladen af kollagenfibril på bevægelse og infiltration af ioner i en biomimetisk model. Kredit:Science Advances, doi:10.1126/sciadv.aav9075.
Levende organismer danner biologiske mineraler under biomineralisering, hvor uorganiske elementer selektivt kan deponere på specifikke organiske makromolekyler under præcis kontrol. Processen kan opdeles i biokalkning eller biosilicering baseret på den uorganiske komponent, med kollagen brugt som en universel skabelon. Under intrafibrillar mineralisering, kollagenmatricer, der er bestemt til mineralisering hos hvirveldyr, indeholder overfladebundne matrixproteiner. At forstå de komplekse mekanismer for intrafibrillær mineralisering til dannelse af hårdt kollagenholdigt væv, såsom knogler og dentin, er af betydelig interesse for biomekanik, med årtiers undersøgelser udført for at efterligne eller modellere processen i laboratoriet. I en nylig undersøgelse, nu udgivet i Videnskab fremskridt , Q. Sang og kolleger på de tværfaglige biologiske afdelinger, Anvendt fysik, Materialevidenskab og teknik, Biomedicinsk videnskab og tandlæge, i Kina, USA og Italien, har udviklet en biomekanisk model til undersøgelse af kollagen-ligand-interaktioner, der bidrager til intrafibrillær mineralisering.
I undersøgelsen, de brugte negativt ladet, højmolekylær polycarboxylsyre, tværbundet til rekonstitueret kollagen, at skabe den biomimetiske model. De udførte kryogen elektronmikroskopi og molekylær dynamiksimuleringer, for at vise, at kædelignende aggregater dannes efter krydsbinding til kollagen, langs den fibrillære overflade for at implementere fibrillær mineralisering. De observerede, at de negativt ladede, mineraliserede stilladser tillod dem at opnå højere kvalitet med bedre biomekaniske egenskaber, sammenlignet med mineralisering på umodificerede stilladser. Arbejdet med kollagen-ligand-interaktion gav forskerne indsigt i oprindelsen til heterogent mineraliserede væv og tydeliggjorde også de potentielle årsager til ektopisk forkalkning (upassende biomineralisering) i ikke-mineraliserede kropsvæv.
Biomineraler, der forekommer i naturen, indeholder i sig selv calcium for at danne calciumphosphat (CaP) og octacalciumphosphat som eksempler. CaP-holdige biomineraler udgør specifikt hvirvelhårdt bindevæv, der henviser til, at calciumcarbonat danner det invertebrale skelet. Kollagenfibriller kan bruges som mineraliseringsskabeloner på grund af nanoskala -kanaler i deres fibrillære strukturer til dannelse af nanoenginerede hybrider med kombineret styrke og modstandsdygtighed. Imidlertid, processen kan ikke opnås ved blot at nedsænke kollagenmatricer i en overmættet opløsning af mineralioner, i stedet kræver brug af nukleationshæmmere til stabilisering af ionforeningskomplekser og forhindring af deres krystallisering uden for fibrillerne. Som resultat, i det sidste årti, forskere har foreslået forskellige in vitro -modeller for at forstå mekanismerne for intrafibrillær mineralisering. I de foregående studiemodeller, hæmmere af krystalkernen blev inkluderet i mineraliseringsmediet og ikke bundet til kollagenfibrillerne, afviger fra det typiske scenario, der fandt sted i biologiske systemer. I den foreliggende undersøgelsesmodel, Song et al. tillod derfor inhibitorerne at binde kollagenfibrillerne for tilstrækkelig biomimik.
Karakterisering af PAA-kollagen. (A) Infrarøde spektre af PAA-kollagensvampe. Spektre blev normaliseret langs kollagenamid A -toppen (~ 3300 cm − 1, NH -stretch kombineret med hydrogenbinding) Sammenlignet med spektret af bart kollagen, spektrene af HPAA-bundet kollagen (HPAA-collagen) og LPAA-bundet kollagen (LPAA-collagen) svampe viser stigninger i amid B, JEG, II, og III toppe. (B) Solid overflade ζ potentiale for HPAA-kollagen, LPAA-kollagen, og bare kollagen. Tværbinding af PAA til kollagenmolekylet resulterede i signifikant lavere ζ potentialer på -17,17 ± 1,98 mV for HPAA-kollagen, −15,19 ± 1,22 mV for LPAA-kollagen, og -3,04 ± 0,37 mV for bart kollagen. (C og D) Sammenligning af carboxyl (C) og amingrupper (D) mellem PAA-kollagen og bart kollagen. Efter anionisk ændring, mængderne af carboxylgruppe (i mM/g kollagen) i HPAA-collagen (1,907 ± 0,084) og LPAA-collagen (1,807 ± 0,035) var signifikant højere end mængden af det bare collagen (0,460 ± 0,017). Kredit:Science Advances, doi:10.1126/sciadv.aav9075. 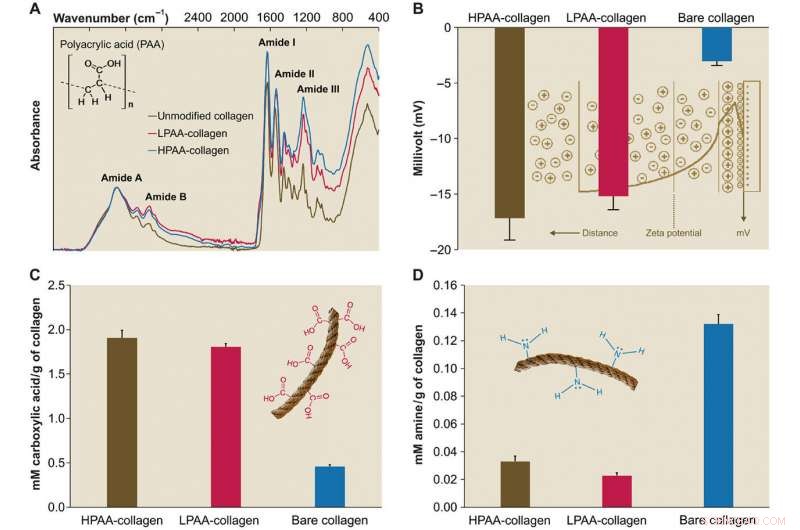
Da fysiologiske ikke -kollagene proteiner er vanskelige at ekstrahere og funktionelt komplekse til brug i biomimetiske mineraliseringsundersøgelser, Song et al. brugte anioniske polyelektrolytter som nukleationshæmmere i deres model for intrafibrillær mineralisering. Anioniske polyelektrolytter kan efterligne den meget anioniske og iboende forstyrrede proteinkonformation, der findes i ikke -kollagene proteiner. I den foreslåede model, polyelektrolyt-nukleationshæmmere bundet til matrixproteinfrit rekonstitueret kollagen som modeller for intrafibrillær mineralisering. Song et al. simulerede først molekylær dynamik for at vise, at en polyelektrolyt, såsom polyacrylsyre (PAA), kunne reservere calcium- og hydrogenphosphationkomplekser til kædelignende aggregater langs overfladen af makromolekylet ved introduktion i et overmættet CaP-mineraliseringsmedium.
Baseret på den simulerede molekylære dynamik, Song et al. udviklet en testhypotese om, at en kernehæmmer, der er bundet til overfladen af kollagenfibriller, kunne stabilisere CaP -mineraliseringsforstadier nær fibrillerne, for effektiv intrafibrillar mineralisering. For at teste hypotesen, de brugte kontroller med en ubundet version af den samme polyelektrolyt, der blev brugt til at stabilisere de CaP -forstadier, der indgår i mineraliseringsmediet i stedet.

Simulering af den sene fase af intrafibrillær mineralisering af HPAA-kollagen. 3D-gengivelse af den sene fase af intrafibrillar mineralisering af HPAA-kollagen, der viser ophobning af prenukleationsklynge-aggregater (gul) langs fibriloverfladen; intrafibrillære mineraler er afbildet i orange. Kredit:Science Advances, doi:10.1126/sciadv.aav9075.
Forskerne brugte højmolekylær polyacrylsyre - PAA (HPAA) til at simulere osteopontin og lavmolekylær PAA (LPAA) til at simulere osteocalcin. De tværbinder de polyanioniske elektrolytter kemisk for at rekonstituere kollagenfibriller eller svampe af type I ved hjælp af organiske forbindelser og undersøgte polymerkonstitutionen ved hjælp af Fourier transform infrarød spektroskopi (FTIR). Song et al. brugte transmissionselektronmikroskopi (TEM) til at observere PAA-bundne kollagenfibriller, der blev farvet røde og registrerede dem som elektrontætte filamentagtige aggregater på fibriloverfladen. De brugte derefter højeffektiv væskekromatografi til at undersøge egenskaberne ved binding/frigivelse af PAA-kollagensvampe.
Simulering af biomineraliseringens molekylære dynamik
For at forstå de forskellige faser af intrafibrillær mineralisering af HPAA-bundet kollagen (HPAA-kollagen), forskerne lavede film ved hjælp af elektrontomografidata fra de forskellige faser af biomineralisering. De simulerede (1) den tidlige fase - for at vise akkumulering af prenukleationsklynge -aggregater omkring det ikke -mineraliserede kollagenfibril, (2) midtfase - for at vise delvis intrafibrillær mineralisering og (3) sen fase - for at vise kraftig intrafibrillær mineralisering af HPAA -kollagenfibrillerne. De viste, at LPAA-kollagen ikke fremkaldte intrafibrillar mineralisering sammenlignet med HPAA i undersøgelsen, og inkluderede derfor ikke polymererne i de efterfølgende forsøg.

Molekylær dynamiksimuleringer. (A) Profil af nøgne kollagen mikrofibrillære strukturer med vandmolekyler inden for de intrafibrillære rum. Blå bånd, kollagen triple helices; røde prikker, vandmolekyler. (B) set fra siden af nøgne kollagenmikrofibriller. De blå linjer beskriver den 67 nm lange simuleringsboks. (C og D) Bevægelse af Ca2+ (gule kugler), HPO42− (røde samlinger), og samlede CaP-mineraliseringsforstadier (gul-røde forsamlinger) hen over kollagenmikrofibrillerne med HPAA (grøn kæde) bundet til LYS1099-aminosyrerne i kollagenmolekylerne. (E) Top:Simulering af bevægelse af forskellige ioner på tværs af HPAA-collagen mikrofibrillære strukturer på bestemte simuleringstider. Blå kugler, lilla kugler, gule kugler, rød samling, gul-røde forsamlinger, og grøn kæde struktur repræsenterer Na+ ioner, Clioner, Ca2+ ioner, HPO42− ioner, CaP -mineraliseringsforstadier, og HPAA, henholdsvis. Nederst:Dynamiske ændringer i antallet af Ca2+ (sort linje), HPO42− (rød linje), Na+ (grøn linje), og Cl− (blå linje) i intrafibrillære og ekstrafibrillære områder langs a-aksens grænse ved 0, 30, 50, og 70 ns. (F) Bevægelse af Ca2+, HPO42−, og samlede CaP -mineraliseringsforstadier på tværs af de bare kollagenmikrofibriller med ubundet HPAA i den ekstrafibrillære region (kontrol). (G) sammenligning af fordelingen af forskellige ioner inden for det intrafibrillære område i den kollagenbundne HPAA og de ubundne HPAA-mineraliseringsmodeller. (H) sammenligning af rodgennemsnitlig kvadratisk afvigelse af kollagenmolekyler i det kollagenbundne HPAA og de ubundne HPAA-modeller. (I) Sammenligning af opløsningsmiddeltilgængeligt overfladeareal (SASA) af kollagenmolekylerne mellem de to modeller. Kredit:Science Advances, doi:10.1126/sciadv.aav9075.
Song et al. brugte derefter molekylær dynamiksimuleringer af mineraliseringsprocessen til at forstå struktur-til-funktion-forholdet og validerede evnen af kollagenbundet HPAA til at aggregere CaP-mineraliseringsforstadier. For det, de brugte en fuld atomistisk model af det hydratiserede HPAA-collagenfibrilkompleks. I enhedsmodellen, de simulerede Ca 2+ og HPO 4 2- ioner og samlede CaP-mineraliseringsforstadier til dannelse omkring det kollagenbundne HPAA. Arbejdet afslørede fordelingen af natriumioner, chlorid, calcium og HPO 4 2- ioner langs aksen af enhedsmodelgrænsen.
Undersøgelse af ultrastrukturen
Til ultrastrukturelle undersøgelser af den biomimetiske model, Song et al. brugte nanoindentation til at vurdere Youngs moduler af mineraliserede og ikke -mineraliserede kollagenfibriller med atomkraftmikroskopi (AFM). Værdierne lignede dem, der tidligere blev rapporteret for mineraliserede og ikke -mineraliserede fibriller, beregnet ved hjælp af nanoindentation. Forskerne brugte røntgendiffraktionsspektroskopi til at identificere tilstedeværelsen af apatit på de mineraliserede svampe. Undersøgelsen viste, at HPAA-kollagen mineraliseret i CaP-opløsning i syv dage havde et højere mineralindhold end bare kollagen. Når Song et al. beregnet apatit/kollagenforholdet i de spektroskopiske profiler, HPAA-kollagensvampene indikerede højere mineraliseringsniveauer.
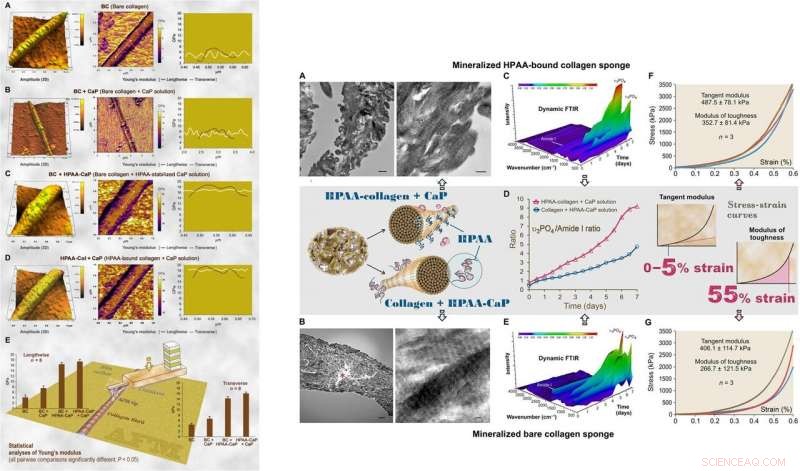
:VENSTRE:AFM for 3D-overfladetopografi og elasticitetsmodul (Youngs modul) kortlægning af repræsentativ lufttørret, mineraliseret bare kollagen og HPAA-kollagenfibriller. (A) Bare kollagenfibriller (BC) havde en tæt på normal fordeling af Youngs modul på tværs af fibrillen. (B) Bare kollagen mineraliseret i CaP -opløsning uden nukleationshæmmer (BC + CaP). (C) Bare kollagen mineraliseret med HPAA-CaP-opløsning (BC + HPAA-CaP). (D) HPAA-kollagen mineraliseret med CaP-opløsning uden nukleationshæmmer (HPAA-Col + CaP). (E) Statistiske analyser af Youngs modul af kollagenfibril i længderetningen og på tværs (n =8). HØJRE:Karakterisering af mineraliserede HPAA-kollagensvampe og bare kollagensvampe. (A) TEM af mineraliserede HPAA-kollagensvampe. (B) TEM af mineraliserede bare kollagensvampe. (C) Dynamisk svækket total refleksion (ATR) –FTIR viser progressiv mineralisering af en HPAA-kollagensvamp med 12 timers intervaller over en 7-dages periode. (D) Ændringer i forholdet mellem apatit υ3PO4/kollagenamid I -forhold mellem mineraliserede anioniske kollagensvampe og umodificerede kollagensvampe. E) Dynamic ATR-FTIR viser fremskridtet med mineraliseringen af en bare kollagensvamp i HPAA-CaP-opløsning. (F) Stress-belastningsrespons af mineraliserede HPAA-kollagensvampe til bestemmelse af tangentmodul og hårdhedsmodul (indsat, midterste række). (G) Stress-stamme respons af mineraliserede bare kollagensvampe. Kredit:Science Advances, doi:10.1126/sciadv.aav9075.
Modulet af sejhed, som typisk angiver den energi pr. volumenhed, som et materiale kan absorbere, før det brister, var også signifikant højere for HPAA-kollagensvampe, hvilket indikerer materialets brudresistens. Sådanne funktioner tegner sig for den høje modstandsdygtighed af biomineraliserede kollagenbaserede væv, der efterligner knoglemikroarkitektur for at kombinere knogleegenskaberne ved sejhed og styrke i regenerativ teknik. Song et al. krediterede de observerede egenskaber ved kohesiv/vedhæftning til HPAA -tværbinding, som gjorde det muligt at skabe kollagen/mineralkomposit, ligner det tværbundne osteopontin, der findes i knoglearkitektur.
Anvendelser af de nye biokompatible konstruktioner
Da biokompatibilitet af nye materialer er et vigtigt element i materialevidenskab og bioingeniør, Song et al. verificerede gunstige celle-materiale-interaktioner på HPAA-tværbundet kollagen ved hjælp af stamcelles levedygtighed og proliferation under in-lab knogleregenerering cellekultur. Når forskerne gennemførte mitokondrielle dehydrogenase- og apoptose -assays på humane mesenkymale stamceller, de observerede ikke signifikante forskelle mellem det unmineraliserede HPAA-kollagen og bare kollagensvampe. På grund af deres kompatibilitet med humane osteoblastlignende celler, sådanne materialer kan bruges som biokompatible belægninger til kirurgiske implantater.
På denne måde, Song et al. demonstreret en biomekanisk model for forbedring af intrafibrillar mineralisering ved hjælp af kollagen-ligand-interaktioner for at forstå de stedsspecifikke mekanismer. Denne model for kollagen-ligand-interaktioner kan også kaste lys over de potentielle årsager til ektopisk mineralisering, som er af interesse i øjeblikket. I perspektivet af Song et al., intrafibrillar mineralisering via kollagen-ligand-interaktioner kan infiltrere mineraler mere konsekvent i bulk-kollagenmatricer til anvendelser inden for regenerativ medicin. Resultaterne hjælper med at forstå de biomekaniske egenskaber, samtidig reducere fejl for at øge de biomimetiske egenskaber ved en mineraliseret kollagenmatrix i vævsteknik.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 Syntetiserer et dødeligt svampetoksinKredit:American Chemical Society Dødskapssvampen har en lang historie som et redskab til mord og selvmord, går tilbage til oldtidens romertid. Svampen, Amanita phalloides , producerer et af verd
Syntetiserer et dødeligt svampetoksinKredit:American Chemical Society Dødskapssvampen har en lang historie som et redskab til mord og selvmord, går tilbage til oldtidens romertid. Svampen, Amanita phalloides , producerer et af verd -
 Den første hydroxidledningsevne i anionledende polymer tynde filmFigur 1:Den første måling af hydroxidledningsevne og sammenligning i anionledende polymer tynde film. (X =OH og Br). Kredit:Japan Advanced Institute of Science and Technology Efterhånden som dekar
Den første hydroxidledningsevne i anionledende polymer tynde filmFigur 1:Den første måling af hydroxidledningsevne og sammenligning i anionledende polymer tynde film. (X =OH og Br). Kredit:Japan Advanced Institute of Science and Technology Efterhånden som dekar -
 Når FRETING over cancerbiomarkører ikke virker, fokusere på at blinke i stedet forSkematisk repræsentation af fluorescensblink styret af tripletdannelse og triplet-triplet energioverførsel. Kredit:Osaka University Fluorescensspektroskopi er uundværlig i biomedicinsk diagnostik.
Når FRETING over cancerbiomarkører ikke virker, fokusere på at blinke i stedet forSkematisk repræsentation af fluorescensblink styret af tripletdannelse og triplet-triplet energioverførsel. Kredit:Osaka University Fluorescensspektroskopi er uundværlig i biomedicinsk diagnostik. -
 Bekæmpelse af et mægtigt ukrudtKredit:CC0 Public Domain Ukrudt er irriterende i enhver situation. Nu, forestil dig et ukrudt, der er så besværligt, at det har muteret til at modstå flere herbicider. Palmer amaranth, et medlem a
Bekæmpelse af et mægtigt ukrudtKredit:CC0 Public Domain Ukrudt er irriterende i enhver situation. Nu, forestil dig et ukrudt, der er så besværligt, at det har muteret til at modstå flere herbicider. Palmer amaranth, et medlem a
- Century-skala dybvandscirkulationsdynamik i det nordlige Atlanterhav
- iPhone for at dele rampelyset med tjenester ved Apples store begivenhed
- Hvordan kan du se, om en kvantehukommelse virkelig er kvante?
- Rumbårne data til overvågning af myg i folkesundhedens navn
- Forskel mellem et bioom og et økosystem
- Forskere knækker strukturen af nøgleprotein i Zika-virus


