Hvad hjælper en solid med at opløses hurtigere i vand?
1. Omrøring eller agitation: At bevæge opløsningen hjælper med at komme i ferskvand med at komme i kontakt med det faste stof, hvilket øger opløsningshastigheden.
2. Temperatur: Varmere vand har mere kinetisk energi, hvilket får vandmolekylerne til at bevæge sig hurtigere. Denne øgede bevægelse giver dem mulighed for at bryde solidens partikler hurtigere.
3. Overfladeareal: At bryde det faste stof i mindre stykker øger sit overfladeareal. Dette udsætter mere af det faste stof for vandet og fremskynder opløsningsprocessen. Tænk på en sukkerterning vs. granuleret sukker!
4. Opløselighed: Nogle stoffer opløses simpelthen hurtigere end andre. Dette er en iboende egenskab for stoffet, bestemt af dets kemiske sammensætning, og hvor stærkt det interagerer med vandmolekyler.
5. Tryk: Selvom det er mindre relevant for faste stoffer, kan pres spille en rolle i opløsningen af gasser. Højere tryk tvinger flere gasmolekyler ind i opløsningen og øger opløsningshastigheden.
Vigtig note: Det er vigtigt at huske, at "opløsning hurtigere" ikke betyder "at opløse mere". Mængden af et stof, der kan opløses i en given mængde vand ved en bestemt temperatur, kaldes dens opløselighed. Forøgelse af hastigheden for opløsning betyder simpelthen, at stoffet når sin maksimale opløselighed hurtigere.
 Varme artikler
Varme artikler
-
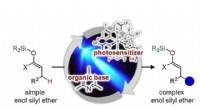 Muliggør selektiv carbon-carbon-bindingsdannelse i enolsilylethers iboende inaktive positionFigur:En ny transformation til effektiv syntese af komplekse organiske molekyler Nagoya University forskere har opdaget en ny måde at ændre reaktanter, der er blevet bredt undersøgt og anvendt i o
Muliggør selektiv carbon-carbon-bindingsdannelse i enolsilylethers iboende inaktive positionFigur:En ny transformation til effektiv syntese af komplekse organiske molekyler Nagoya University forskere har opdaget en ny måde at ændre reaktanter, der er blevet bredt undersøgt og anvendt i o -
 Forskere udgiver køreplan for at udnytte datavidenskab og kunstig intelligens til elektronmikroskop…Kredit:CC0 Public Domain Siden de blev taget i brug i 1938, elektronmikroskoper har spillet en afgørende rolle i en lang række videnskabelige fremskridt, herunder opdagelsen af nye proteiner og
Forskere udgiver køreplan for at udnytte datavidenskab og kunstig intelligens til elektronmikroskop…Kredit:CC0 Public Domain Siden de blev taget i brug i 1938, elektronmikroskoper har spillet en afgørende rolle i en lang række videnskabelige fremskridt, herunder opdagelsen af nye proteiner og -
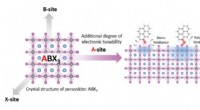 Ny måde at tænde for nanomaterialer til elektroniske applikationerSkematisk af perovskit materiale med organiske molekyler, der kan tilføje til dets elektroniske egenskaber. Kredit:Jingjing Xue og Rui Wang/UCLA Samueli School of Engineering UCLA materialeforsker
Ny måde at tænde for nanomaterialer til elektroniske applikationerSkematisk af perovskit materiale med organiske molekyler, der kan tilføje til dets elektroniske egenskaber. Kredit:Jingjing Xue og Rui Wang/UCLA Samueli School of Engineering UCLA materialeforsker -
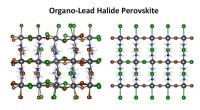 Forskere udvikler innovative teknikker til højopløsningsanalyse af hybridmaterialerSkematisk af organo-blyhalogenidperovskit, der viser forvrængninger fra tilfældige halogenidpositioner (venstre) versus ordnede halogenidpositioner (højre). Et Berkeley Lab-studie viser, at der findes
Forskere udvikler innovative teknikker til højopløsningsanalyse af hybridmaterialerSkematisk af organo-blyhalogenidperovskit, der viser forvrængninger fra tilfældige halogenidpositioner (venstre) versus ordnede halogenidpositioner (højre). Et Berkeley Lab-studie viser, at der findes
- Hvilken type reaktion er AL HCL?
- Hvad er de kræfter, der påvirker horisontal luftbevægelse?
- Er sexceller fra en mand og kvinde kendt som gameter?
- Videnskaben går tættere på at forklare den vredes fulde
- Hvordan har forbruget af energi ændret sig i de sidste 50 år?
- Interiør af jordens definition geologi?


