Har flydende tilstand mere tæthed end gastilstand?
* Partikelarrangement: I en væske er partiklerne meget tættere sammen end i en gas. De er stadig i konstant bevægelse, men de holdes sammen af stærkere intermolekylære kræfter.
* Kompressibilitet: Væsker er meget mindre komprimerbare end gasser. Dette betyder, at partiklerne i en væske ikke kan presses så tæt sammen som partiklerne i en gas.
* bind: Væsker har et bestemt volumen, mens gasser tager form og volumen på deres beholder. Dette betyder, at væsker har en mere fast mængde stof i et givet rum.
Eksempel: Tænk på vand. Flydende vand er tættere end vanddamp (damp). Dette er grunden til, at is flyder - det er mindre tæt end flydende vand.
Undtagelser:
Der er nogle undtagelser fra denne generelle regel. For eksempel kan en gas under ekstremt tryk blive tættere end en væske. Dette sker i nogle stjerner og i visse industrielle processer.
Sidste artikelHvad er de 3 egenskaber ved subatomære partikler?
Næste artikelHvordan overføres varme fra et molekyle til et andet?
 Varme artikler
Varme artikler
-
 Styring af vitamin K2-produktion i tuberkulosebakterierneSå vidt vi ved, det er første gang, at allosterisk regulering er blevet rapporteret for biosyntesevejen for menaquinon (vitamin K2) i ethvert livsdomæne, ” siger ledende efterforsker og universitetsle
Styring af vitamin K2-produktion i tuberkulosebakterierneSå vidt vi ved, det er første gang, at allosterisk regulering er blevet rapporteret for biosyntesevejen for menaquinon (vitamin K2) i ethvert livsdomæne, ” siger ledende efterforsker og universitetsle -
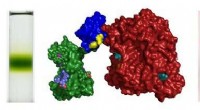 Team udvikler fotosyntetiske proteiner til udvidet solenergiomdannelseProteiner fra en grøn plante og en lilla bakterie låses sammen af et genetisk kodet grænseflade-domæne (blå/gul). Kredit:University of Bristol Et team af forskere, ledet af University of Bristol
Team udvikler fotosyntetiske proteiner til udvidet solenergiomdannelseProteiner fra en grøn plante og en lilla bakterie låses sammen af et genetisk kodet grænseflade-domæne (blå/gul). Kredit:University of Bristol Et team af forskere, ledet af University of Bristol -
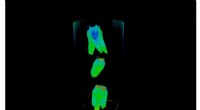 Forskere bruger neutroner til at forsøge at udvikle sig bedre, mindre omkostningskrævende tandrest…Neutronspredning ved ORNLs High Flux Isotope Reactor blev brugt til at studere effektiviteten af tandimplantater. Neutronbilleder illustrerer genoprettende materialer bundet til tandstrukturen via E
Forskere bruger neutroner til at forsøge at udvikle sig bedre, mindre omkostningskrævende tandrest…Neutronspredning ved ORNLs High Flux Isotope Reactor blev brugt til at studere effektiviteten af tandimplantater. Neutronbilleder illustrerer genoprettende materialer bundet til tandstrukturen via E -
 Kemikere bruger lys til at bygge biologisk aktive forbindelserSyntese af isoquinuclidiner ved hjælp af den blå LED-aktiverede fotokemi. Kredit:Jiajia Ma Nogle af de mest biologisk aktive molekyler, herunder syntetiske stoffer, indeholde en central, nitrogenh
Kemikere bruger lys til at bygge biologisk aktive forbindelserSyntese af isoquinuclidiner ved hjælp af den blå LED-aktiverede fotokemi. Kredit:Jiajia Ma Nogle af de mest biologisk aktive molekyler, herunder syntetiske stoffer, indeholde en central, nitrogenh
- Hvad sker der med molekyler, når der tilsættes varme?
- Hvorfor vises månen og solen i daghimmelen ikke fuld?
- Klimaændringer vokser hurtigt, siger global undersøgelse
- Nyt princip for selvmontering af mønstrede nanopartikler
- Hvorfor er det vigtigt at have ioner i en løsning til at udføre elektricitet?
- Teknik strømliner fremstilling af 2-D kredsløb


