Hvordan er to isotoper af et element forskellige?
Her er en sammenbrud:
* Element: Defineret af antallet af protoner i sin kerne. Alle atomer i et specifikt element har det samme antal protoner.
* isotoper: Atomer af det samme element, der har forskellige antal neutroner . Dette betyder, at de har det samme atomnummer (antal protoner), men forskellige atommasse (antal protoner + neutroner).
Her er et eksempel:
* carbon-12 Har 6 protoner og 6 neutroner.
* carbon-14 Har 6 protoner og 8 neutroner.
Begge er carbonatomer (fordi de har 6 protoner), men de har forskellige antal neutroner. Denne forskel i neutronantal gør dem isotoper.
Nøgle takeaways:
* Isotoper af det samme element har de samme kemiske egenskaber, fordi de har det samme antal elektroner, der bestemmer, hvordan et atom interagerer med andre atomer.
* Isotoper kan have forskellige fysiske egenskaber, såsom densitet og radioaktive forfaldshastigheder, på grund af det forskellige antal neutroner.
 Varme artikler
Varme artikler
-
 Ny antimikrobiel belægning kan være nøglen i kampen mod hospitalserhvervede infektionerKredit:CC0 Public Domain Forskere ved University of Birmingham har skabt en antimikrobiel belægning til ståloverflader, som har vist sig hurtigt at dræbe bakterier, der forårsager nogle af de mest
Ny antimikrobiel belægning kan være nøglen i kampen mod hospitalserhvervede infektionerKredit:CC0 Public Domain Forskere ved University of Birmingham har skabt en antimikrobiel belægning til ståloverflader, som har vist sig hurtigt at dræbe bakterier, der forårsager nogle af de mest -
 Omkonstrueret enzym kan hjælpe med at vende skader fra rygmarvsskade og slagtilfældeI denne gengivelse af enzymet chondroitinase ABC, punktmutationer repræsenteres af røde kugler. Denne re-manipulerede form af enzymet er mere stabil og mere aktiv end vildtypen og kan bruges til at hj
Omkonstrueret enzym kan hjælpe med at vende skader fra rygmarvsskade og slagtilfældeI denne gengivelse af enzymet chondroitinase ABC, punktmutationer repræsenteres af røde kugler. Denne re-manipulerede form af enzymet er mere stabil og mere aktiv end vildtypen og kan bruges til at hj -
 Teknologisk stråle af håb for snowboardscenenJakob Schmidt og Marc Fleischmann, forskningsassistenter ved Institut for Tekstilteknologier ved Chemnitz University of Technology, kontrollere kvaliteten af et splitboards præform på pladespilleren
Teknologisk stråle af håb for snowboardscenenJakob Schmidt og Marc Fleischmann, forskningsassistenter ved Institut for Tekstilteknologier ved Chemnitz University of Technology, kontrollere kvaliteten af et splitboards præform på pladespilleren -
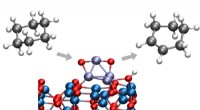 Forskere er banebrydende for den nye kemiske konverteringsproces ved lav temperaturArgonne -kemikere har identificeret en måde at konvertere cyclohexan til cyclohexen eller cyclohexadien, begge vigtige kemikalier i en lang række industrielle processer. Den nye proces finder sted ved
Forskere er banebrydende for den nye kemiske konverteringsproces ved lav temperaturArgonne -kemikere har identificeret en måde at konvertere cyclohexan til cyclohexen eller cyclohexadien, begge vigtige kemikalier i en lang række industrielle processer. Den nye proces finder sted ved
- Hvorfor er det vanskeligt at demonstrere diffraktion af lysbølger?
- Nano-sandwiching forbedrer varmeoverførslen, forhindrer overophedning i nanoelektronikken
- Hvad er hun i kemi står for?
- Amazonas brænder stadig. Kan FN-topmøde i Glasgow tage fat på sådanne klimafejl?
- Er pop en mekanisk blanding eller opløsning?
- Hvilken effekt har jorden på bjerge?


