Hvad gør 2 forbindelser med samme hydrofobi til at have forskellige partitionskoefficienter?
Her er grunden til, at to forbindelser med den samme hydrofobicitet * kan * synes at have forskellige partitionskoefficienter, selvom de i teorien ikke burde:
* målefejl: Opdelingskoefficienter bestemmes eksperimentelt. Der er altid en vis fejl i målingen, især for komplekse molekyler. Små forskelle i K kunne skyldes eksperimentel variation.
* Forskellige hydrofobicitetsskalaer: Der er forskellige måder at kvantificere hydrofobicitet på. Brug af forskellige skalaer (som octanol-vandpartitionskoefficienter vs. andre skalaer) kan føre til lidt forskellige fortolkninger.
* Andre interaktioner: Mens hydrofobicitet er den primære drivkraft for opdeling, kan andre faktorer som:
* Hydrogenbinding: Forbindelser med brintbindingsdonorer eller acceptorer kan interagere forskelligt med den vandige fase, hvilket påvirker deres opdeling.
* polariserbarhed: Et molekyls evne til at reagere på et elektrisk felt (polariserbarhed) kan også påvirke, hvordan det interagerer med faserne.
* form og størrelse: Steriske effekter, som størrelsen og formen på molekylet, kan påvirke, hvor let det passer ind i de to faser.
* Intermolekylære kræfter: Ud over hydrofobicitet kan andre intermolekylære kræfter, som dipol-dipol-interaktioner, påvirke opdeling.
Key Takeaway: Mens hydrofobicitet er en vigtig faktor, er det ikke den eneste. Hvis to forbindelser tilsyneladende har forskellige partitionskoefficienter på trods af lignende hydrofobicitet, skal du kigge efter andre mulige faktorer, der påvirker deres opdelingsadfærd.
Fortæl mig, hvis du gerne vil have mig til at uddybe nogen af disse punkter eller have specifikke eksempler i tankerne!
Sidste artikelEt materiale kan klassificeres som en væske, hvis?
Næste artikelEr gasser mere tætte end væske?
 Varme artikler
Varme artikler
-
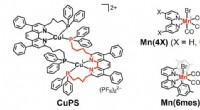 Store fremskridt for kulstoffangst ved hjælp af jordrige elementer som fotokatalytisk systemStrukturen af CuPS, kobberkomplekset, der opfører sig som en redox -lysfølsomhed, og den manganbaserede katalysator udviklet i undersøgelsen. Kredit: Journal of the American Chemical Society Fo
Store fremskridt for kulstoffangst ved hjælp af jordrige elementer som fotokatalytisk systemStrukturen af CuPS, kobberkomplekset, der opfører sig som en redox -lysfølsomhed, og den manganbaserede katalysator udviklet i undersøgelsen. Kredit: Journal of the American Chemical Society Fo -
 PEF udfordrer PET til kampUddannelse og en forbedret bevidsthed om, hvordan plast skal håndteres, vil fortsat være afgørende for at stoppe den stigende miljøforurening, siger ETH-forsker Jan-Georg Rosenboom. Kredit:iStock
PEF udfordrer PET til kampUddannelse og en forbedret bevidsthed om, hvordan plast skal håndteres, vil fortsat være afgørende for at stoppe den stigende miljøforurening, siger ETH-forsker Jan-Georg Rosenboom. Kredit:iStock -
 Nuklear engineering forskere udvikler ny elastisk oxiddispersion styrket legeringKredit:Pixabay/CC0 Public Domain Forskere fra Texas A&M University har for nylig vist overlegen ydeevne af en ny oxiddispersion-forstærket (ODS) legering, de udviklede til brug i både fissions- og
Nuklear engineering forskere udvikler ny elastisk oxiddispersion styrket legeringKredit:Pixabay/CC0 Public Domain Forskere fra Texas A&M University har for nylig vist overlegen ydeevne af en ny oxiddispersion-forstærket (ODS) legering, de udviklede til brug i både fissions- og -
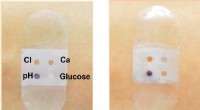 Biosensorbandage opsamler og analyserer svedBiosensorbandage før (venstre) og efter (højre) svedsekretion. Kredit:American Chemical Society Ligesom andre biovæsker, sved indeholder et væld af informationer om, hvad der foregår inde i kroppe
Biosensorbandage opsamler og analyserer svedBiosensorbandage før (venstre) og efter (højre) svedsekretion. Kredit:American Chemical Society Ligesom andre biovæsker, sved indeholder et væld af informationer om, hvad der foregår inde i kroppe
- Er elektrisk og elektro magnetisk energi den samme ting?
- Hvordan gælder princippet for pneumatiske enheder?
- Hvad er nogle eksempler på ikke-tilpasninger?
- Supermarkedshylder blottet? Historien kan lære os at nøjes med mad
- Hvilken gruppe af forskellige populationer organismer kaldes A?
- Hvordan elnet fungerer


