Forklar, hvorfor den specifikke vandvarme er højere end Specifice de fleste andre stoffer?
1. Hydrogenbinding:
- Vandmolekyler er polære med en positiv ladning på brintenden og en negativ ladning på iltenden. Dette giver dem mulighed for at danne stærke brintbindinger med hinanden.
- Disse brintbindinger kræver en betydelig mængde energi for at bryde, hvorfor vand har brug for mere energi for at øge dens temperatur sammenlignet med stoffer med svagere intermolekylære kræfter.
2. Molekylær struktur:
- Den bøjede form af vandmolekylet skaber et tetrahedralt arrangement af brintbindinger. Denne struktur giver mulighed for et stærkt netværk af brintbindinger, hvilket yderligere øger den energi, der er nødvendig for at forstyrre arrangementet.
3. Høj dielektrisk konstant:
- Vandets høje dielektriske konstant betyder, at det effektivt kan screente elektrostatiske interaktioner mellem molekyler, hvilket yderligere forbedrer stabiliteten af brintbindinger.
4. Flydende tilstand:
- Mens andre stoffer muligvis har stærke bindinger i deres faststof, findes der vand som en væske over et bredt temperaturområde. Dette betyder, at hydrogenbindingerne konstant dannes og bryder, hvilket kræver kontinuerlig energiindgang for at opretholde den flydende tilstand.
Konsekvenser af vandets høje specifikke varme:
* Temperaturmoderation: Store vandmasser absorberer en betydelig mængde varme uden drastiske temperaturændringer, hvilket spiller en vigtig rolle i reguleringen af globale temperaturer.
* Klimaregulering: Havene fungerer som køleplade, absorberer varme i løbet af sommeren og frigiver den om vinteren og hjælper moderat kystklima.
* Biologisk betydning: Høj specifik varme hjælper med at opretholde stabile interne kropstemperaturer i levende organismer, hvilket forhindrer drastiske temperatursvingninger.
Sammenfattende skyldes vandets høje specifikke varme primært dens stærke hydrogenbinding, molekylstruktur og dens evne til at eksistere som en væske over et bredt temperaturområde. Denne unikke ejendom har dybe konsekvenser for livet på jorden og dets klima.
 Varme artikler
Varme artikler
-
 Forskere skaber ny aluminiumslegering med fleksibilitet, styrke, lethedDetaljer lavet af Al-Ni-La kompositmateriale Kredit:© Sergey Gnuskov/NUST MISIS Aluminium er et af de mest lovende materialer til luftfarts- og bilindustrien. Forskere fra National University of S
Forskere skaber ny aluminiumslegering med fleksibilitet, styrke, lethedDetaljer lavet af Al-Ni-La kompositmateriale Kredit:© Sergey Gnuskov/NUST MISIS Aluminium er et af de mest lovende materialer til luftfarts- og bilindustrien. Forskere fra National University of S -
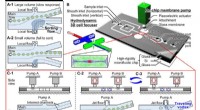 Banebrydende oprensning af fossilt pollen ved hjælp af en ny storpartikel-on-chip sortererKonceptuelle billeder af det foreslåede on-chip sorteringssystem for store partikler baseret på spatiotemporalt genererede rejsehvirvler. (A) Konceptuelle billeder af konventionel partikelsortering på
Banebrydende oprensning af fossilt pollen ved hjælp af en ny storpartikel-on-chip sortererKonceptuelle billeder af det foreslåede on-chip sorteringssystem for store partikler baseret på spatiotemporalt genererede rejsehvirvler. (A) Konceptuelle billeder af konventionel partikelsortering på -
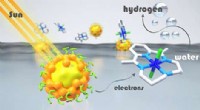 Billigere, mindre giftige og genanvendelige lysabsorbere til brintproduktionKredit:Damien Jouvenot, Departement de Chimie Moléculaire (CNRS/Université Grenoble Alpes) Efterligning af fotosyntese i planter, at bruge lys til at omdanne stabile og rigelige molekyler som vand
Billigere, mindre giftige og genanvendelige lysabsorbere til brintproduktionKredit:Damien Jouvenot, Departement de Chimie Moléculaire (CNRS/Université Grenoble Alpes) Efterligning af fotosyntese i planter, at bruge lys til at omdanne stabile og rigelige molekyler som vand -
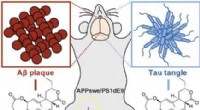 Rodbakterie til at bekæmpe Alzheimers:Rhizolutin adskiller beta- og tau-aggregaterKredit: Angewandte Chemie International Edition En bakterie fundet i jorden tæt på rødderne af ginsengplanter kunne give en ny tilgang til behandling af Alzheimers. Rhizolutin, en ny klasse af fo
Rodbakterie til at bekæmpe Alzheimers:Rhizolutin adskiller beta- og tau-aggregaterKredit: Angewandte Chemie International Edition En bakterie fundet i jorden tæt på rødderne af ginsengplanter kunne give en ny tilgang til behandling af Alzheimers. Rhizolutin, en ny klasse af fo


