Hvad sker der, når et stof skifter tilstand fra fast eller væske?
fast til væske (smeltning):
* Energi absorberes: Varmeenergi absorberes af det faste stof, hvilket får molekylerne til at vibrere hurtigere.
* afstand mellem molekyler øges: Når vibrationerne øges, begynder molekylerne at bryde fri fra deres faste positioner i den faste struktur.
* struktur svækkes: Den organiserede, stiv struktur af de faste nedbrydninger.
* væskeegenskaber dukker op: Molekylerne er nu frie til at bevæge sig forbi hinanden, hvilket giver stoffet mulighed for at flyde (en egenskab af væsker).
væske til gas (kogning eller fordampning):
* Energi absorberes: Varmeenergi absorberes af væsken, hvilket yderligere øger de molekylære vibrationer.
* afstand mellem molekyler øges dramatisk: Molekylerne får nok energi til at overvinde de attraktive kræfter, der holder dem sammen i flydende tilstand og undslipper i gasfasen.
* væskeegenskaber bliver mere markante: Molekylerne er nu meget langt fra hinanden og bevæger sig frit, hvilket resulterer i, at gassen udvides til at fylde sin beholder.
Vigtig note: De modsatte processer (frysning og kondens) involverer frigivelse af varmeenergi, når stoffet ændrer tilstand.
Her er en simpel analogi:
* Forestil dig molekylerne i et solidt som mennesker i en overfyldt metrobil. De er tæt pakket og kan kun bevæge sig lidt.
* Når det faste smelter, er det som metroen, der åbnes, og folk kan bevæge sig frit, men stadig forblive i bilen. Dette er den flydende tilstand.
* Når væsken koger, er det som om alle, der hopper ud af metrobilen og spreder sig ud over platformen. Dette er gasstaten.
Sidste artikelFungerer vanddamp som perfekt gas?
Næste artikelHvad sker der med densiteten af stoffet under termisk ekspansion?
 Varme artikler
Varme artikler
-
 Ultrabright røntgenstråler afslører den molekylære struktur af membraner, der bruges til afsaltn…Qinyi Fu, Francisco J. Medellin-Rodriguez, Nisha Verma, og Benjamin Ocko (fra venstre mod højre) forbereder sig på at montere de membranprøver, der efterligner de membraner, der bruges i omvendt osmos
Ultrabright røntgenstråler afslører den molekylære struktur af membraner, der bruges til afsaltn…Qinyi Fu, Francisco J. Medellin-Rodriguez, Nisha Verma, og Benjamin Ocko (fra venstre mod højre) forbereder sig på at montere de membranprøver, der efterligner de membraner, der bruges i omvendt osmos -
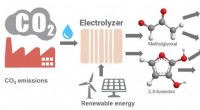 Hvordan man omdanner klimaforandrende kuldioxid til plast og andre produkterDette billede viser, hvordan kuldioxid kan omdannes elektrokemisk til værdifulde polymer- og lægemiddelprækursorer. Kredit:Karin Calvinho/Rutgers University-New Brunswick Rutgers-forskere har udvi
Hvordan man omdanner klimaforandrende kuldioxid til plast og andre produkterDette billede viser, hvordan kuldioxid kan omdannes elektrokemisk til værdifulde polymer- og lægemiddelprækursorer. Kredit:Karin Calvinho/Rutgers University-New Brunswick Rutgers-forskere har udvi -
 Forskere skaber smart stål, 30% stærkereDjalal Mirzayev. Kredit:SUSU Forskere fra South Ural State University arbejder på at producere en innovativ, superlys, og superstærk slags stål kaldet bainit. Dette nye materiale har potentielle a
Forskere skaber smart stål, 30% stærkereDjalal Mirzayev. Kredit:SUSU Forskere fra South Ural State University arbejder på at producere en innovativ, superlys, og superstærk slags stål kaldet bainit. Dette nye materiale har potentielle a -
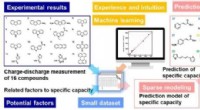 Bedste ydeevne af organisk materiale til lithiumbatterianode ved brug af materialeinformatikAccelereret opdagelse af højtydende organisk anode baseret på eksperimentorienteret MI. Kredit:© Yuya Oaki På JST Strategic Basic Research Programs, forskningsgruppen ledet af lektor Yuya Oaki og
Bedste ydeevne af organisk materiale til lithiumbatterianode ved brug af materialeinformatikAccelereret opdagelse af højtydende organisk anode baseret på eksperimentorienteret MI. Kredit:© Yuya Oaki På JST Strategic Basic Research Programs, forskningsgruppen ledet af lektor Yuya Oaki og
- Billig produktionsteknologi til sofistikerede mikroreaktorer ved overfladebehandlingsteknik ved hjæ…
- Hvad er sukkeret fra en vandig sød blanding?
- Hvordan opstår en oversvømmelse?
- Hvilken beskriver øget effektiviteten af en energiressource?
- I geologiske tidsspidser opdeles i?
- Lab-dyrkede horn og stødtænder kunne stoppe krybskytteri - eller ej


