Hvordan tror du, at molekylerne bevæger sig i varm og kold luft?
i varm luft:
* hurtigere bevægelse: Molekyler i varm luft har mere kinetisk energi (bevægelsesenergi). De bevæger sig hurtigere og kolliderer oftere med hinanden og væggene i deres beholder.
* Større afstand: Den øgede energi får molekylerne til at sprede sig længere fra hinanden. Dette er grunden til, at varm luft er mindre tæt end kold luft.
* Højere pres: De hyppigere kollisioner af molekylerne mod væggene i deres container resulterer i højere tryk.
i kold luft:
* langsommere bevægelse: Molekyler i kold luft har mindre kinetisk energi. De bevæger sig langsommere og kolliderer sjældnere.
* tættere afstand: Med lavere energi er molekylerne tættere sammen, hvilket gør kold luft tættere end varm luft.
* lavere tryk: De færre kollisioner resulterer i lavere tryk.
Tænk på det sådan: Forestil dig et værelse fuld af mennesker. Når det er varmt, er alle begejstrede, bevæger sig hurtigt rundt og støder på hinanden. I et koldt rum er alle mere afslappede, bevæger sig langsomt og forbliver tæt sammen.
Nøglekoncepter:
* Temperatur: Et mål for den gennemsnitlige kinetiske energi af molekyler. Højere temperatur betyder hurtigere bevægelse.
* densitet: Et mål for, hvor tæt pakket molekyler er. Varm luft er mindre tæt, fordi molekylerne er spredt.
* tryk: Kraften udøvet af molekylerne på væggene på deres beholder. Højere temperatur fører til højere tryk på grund af øgede kollisioner.
Sidste artikelHvorfor flyder gas på vandet?
Næste artikelSyntesen af komplekse molekyler fra enklere med inputenergien kaldes?
 Varme artikler
Varme artikler
-
 Stabilisering af en klippe ved hjælp af biominerale bindemidlerKredit:Ecole Polytechnique Federale de Lausanne EPFL-spin-off Medusoil har med succes testet sin jordstabiliseringsproces på klipper udsat for overfladeerosion. Virksomhedens biomineralbaserede lø
Stabilisering af en klippe ved hjælp af biominerale bindemidlerKredit:Ecole Polytechnique Federale de Lausanne EPFL-spin-off Medusoil har med succes testet sin jordstabiliseringsproces på klipper udsat for overfladeerosion. Virksomhedens biomineralbaserede lø -
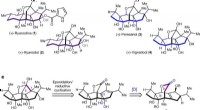 Kemikere syntetiserer perseanol for første gangen, Kemisk struktur, kulstofnummerering og ringsystembogstav tildeling for ryanodane (a) og isoryanodane (b) diterpener. c, Retrosyntetisk analyse af isoryanodane diterpen (+)-perseanol. [O], oxidatio
Kemikere syntetiserer perseanol for første gangen, Kemisk struktur, kulstofnummerering og ringsystembogstav tildeling for ryanodane (a) og isoryanodane (b) diterpener. c, Retrosyntetisk analyse af isoryanodane diterpen (+)-perseanol. [O], oxidatio -
 Meget elastisk biologisk nedbrydelig hydrogel til bioprint af nyt vævYi Hong, UTA professor i bioteknik og leder af projektet. Kredit:UTA Forskere ved University of Texas i Arlington har udviklet en meget elastisk biologisk nedbrydelig hydrogel til bio-printning af
Meget elastisk biologisk nedbrydelig hydrogel til bioprint af nyt vævYi Hong, UTA professor i bioteknik og leder af projektet. Kredit:UTA Forskere ved University of Texas i Arlington har udviklet en meget elastisk biologisk nedbrydelig hydrogel til bio-printning af -
 Video:Sådan fungerer barbercremeKredit:The American Chemical Society Uanset om du rocker sideburns eller babyglatte ben, alle barbermaskiner deler en bekymring-truslen om knivskarpt metal. Men heldigvis, barbercreme pakker den r
Video:Sådan fungerer barbercremeKredit:The American Chemical Society Uanset om du rocker sideburns eller babyglatte ben, alle barbermaskiner deler en bekymring-truslen om knivskarpt metal. Men heldigvis, barbercreme pakker den r
- Mineraler, der indeholder svovl og ilt?
- Hvad er en kovalent obligation?
- International indsats afslører 157 dages cyklus i usædvanlige kosmiske radioudbrud
- Hvorfor er det usandsynligt at finde fossiler i marmor?
- Hvordan kan brugen af plast i landbruget blive mere bæredygtig?
- Går det meste af din løn til husleje? Det kan skade helbredet


