Hvad er de egenskaber, som alle væsker deler?
1. Bestemt volumen, men ubestemt form:
* Væsker optager et specifikt volumen, hvilket betyder, at de optager en fast mængde plads.
* De mangler dog en fast form og tager i stedet formen på deres beholder.
2. Høj densitet og inkomprimerbarhed:
* Væsker er generelt tættere end gasser på grund af deres tættere molekylær afstand.
* De er også meget mindre komprimerbare end gasser, hvilket betyder, at deres volumen ændres meget lidt under pres.
3. Fluiditet og viskositet:
* Væsker er flydende, hvilket betyder, at de let kan flyde og ændre form.
* Viskositet beskriver en væskes modstand mod flow. Nogle væsker er meget tyktflydende (som honning), mens andre er mindre tyktflydende (som vand).
4. Overfladespænding:
* Væsker udviser overfladespænding, en sammenhængende kraft, der trækker molekyler ved overfladen tættere sammen. Dette skaber en tynd, elastisk "hud" på væskens overflade.
5. Kapillær handling:
* Væsker kan stige i smalle rør (kapillærer) på grund af en kombination af overfladespænding og klæbende kræfter mellem væsken og rørets vægge.
6. Diffusion og fordampning:
* Væsker oplever diffusion, hvor molekyler spredte sig fra områder med høj koncentration til lav koncentration.
* Fordampning er en proces, hvor flydende molekyler får nok energi til at flygte ind i gasfasen.
7. Kogepunkt og frysepunkt:
* Hver væske har et specifikt kogepunkt og frysepunkt, hvor den overgår til henholdsvis en gas eller fast stof.
8. Termisk ekspansion:
* Ligesom faste stoffer udvides væsker, når de opvarmes og sammentrækkes, når de afkøles.
Disse egenskaber er et resultat af det specifikke arrangement og bevægelse af molekyler i en flydende tilstand. Mens de kan udvise disse egenskaber i forskellige grader, deler alle væsker disse grundlæggende egenskaber.
Sidste artikelHvad er resonansenergien fra cyclooctatetraene?
Næste artikelI den kemiske kortfældning repræsenterer 14C fjorten antal?
 Varme artikler
Varme artikler
-
 Enkelte atomer bryder carbons stærkeste bindingBrookhaven videnskabsmand Eli Stavitski er vist ved NSLS-IIs Indre Shell Spectroscopy beamline, hvor forskere afbildede den fysiske og kemiske kompleksitet af en enkelt-atom katalysator, der bryder ku
Enkelte atomer bryder carbons stærkeste bindingBrookhaven videnskabsmand Eli Stavitski er vist ved NSLS-IIs Indre Shell Spectroscopy beamline, hvor forskere afbildede den fysiske og kemiske kompleksitet af en enkelt-atom katalysator, der bryder ku -
 Ligesom Wolverine, mennesker har brug for metal for at opretholde stærke knoglerKredit:University of Manchester Et internationalt team af forskere, ledet af University of Manchester, har brugt det britiske Diamond Light Source-anlæg (billedet ovenfor) til at afbilde den præci
Ligesom Wolverine, mennesker har brug for metal for at opretholde stærke knoglerKredit:University of Manchester Et internationalt team af forskere, ledet af University of Manchester, har brugt det britiske Diamond Light Source-anlæg (billedet ovenfor) til at afbilde den præci -
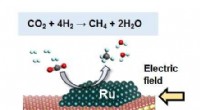 Ny metode omdanner kuldioxid til metan ved lave temperaturerHydrogenering af CO2 til CH4. Kredit:Sekine Laboratory, Waseda Universitet En ny metode udviklet af et team af Waseda-universitetets forskere under ledelse af professor Yasushi Sekine kan bidrage
Ny metode omdanner kuldioxid til metan ved lave temperaturerHydrogenering af CO2 til CH4. Kredit:Sekine Laboratory, Waseda Universitet En ny metode udviklet af et team af Waseda-universitetets forskere under ledelse af professor Yasushi Sekine kan bidrage -
 Prions:Nyt muligt terapeutisk mål opdagetprioner. Kredit:National Institute of Health Prionsygdomme, såsom bovin spongiform encephalopati (kogalskab), er dødelige neurodegenerative infektionssygdomme, som påvirker mennesker og andre patte
Prions:Nyt muligt terapeutisk mål opdagetprioner. Kredit:National Institute of Health Prionsygdomme, såsom bovin spongiform encephalopati (kogalskab), er dødelige neurodegenerative infektionssygdomme, som påvirker mennesker og andre patte
- Hvilken slags støj laver solen?
- Hvad vil gravitationsattraktionen mellem 2 objekter gøre, hvis man har mere masse?
- Hvilken type energi bruger en glødestok?
- Forskning ser på den hvide arbejderklasses syn på identitet, race og immigration
- Første og anden lov om termodynamik?
- Hvad er navnet på benzen med en NH2-gruppe?


