Hundrede tyve gram metal ved 88 graders celsius hældes i en 70 isoleret kop indeholder 250 vand 16 Celsius. Den endelige temperatur Blandingen 17,5 celc?
forståelse af koncepterne
* Varmeoverførsel: Når genstande ved forskellige temperaturer kommer i kontakt, strømmer varme fra det varmere objekt til det koldere objekt, indtil de når termisk ligevægt (den samme temperatur).
* Specifik varmekapacitet: Mængden af varmeenergi, der kræves for at hæve temperaturen på 1 gram af et stof med 1 graders celsius.
Beregninger
1. Identificer variabler:
* Mass af metal (m₁):120 gram
* Den første temperatur på metal (T₁):88 ° C
* Mass af vand (M₂):250 gram
* Indledende temperatur på vand (T₂):16 ° C
* Den endelige temperatur på blandingen (T):17,5 ° C
* Specifik varmekapacitet af vand (C₂):4.184 J/G ° C (vi antager, at dette er det samme for metallet, men hvis du kender metallet, kan du bruge dets specifikke varmekapacitet)
2. Anvend varmeoverførselsligningen:
Den varme, der er mistet af metallet (q₁), er lig med den varme, der er opnået ved vandet (q₂):
Q₁ =Q₂
* Q₁ =m₁ * c₁ * (t₁ - t)
* Q₂ =m₂ * c₂ * (t - t₂)
3. Løs for metalens specifikke varmekapacitet (C₁):
Da vi kender alle de andre variabler undtagen C₁, kan vi omarrangere ligningen og løse:
m₁ * c₁ * (t₁ - t) =m₂ * c₂ * (t - t₂)
c₁ =(m₂ * c₂ * (t - t₂)) / (m₁ * (t₁ - t))
C₁ =(250 g * 4,184 J / g ° C * (17,5 ° C - 16 ° C)) / (120 g * (88 ° C - 17,5 ° C))
C₁ ≈ 0,42 J/g ° C
Konklusion
Metalets specifikke varmekapacitet er ca. 0,42 J/g ° C.
Vigtig note: Vandets specifikke varmekapacitet er en almindelig værdi, men metalens specifikke varmekapacitet varierer afhængigt af metaltypen. Hvis du kender metalens identitet, kan du slå dens specifikke varmekapacitet op og verificere beregningerne.
Sidste artikelHar temperaturen ingen indflydelse på fase?
Næste artikelHvorfor en terning platonisk fast stof?
 Varme artikler
Varme artikler
-
 Nanopartikler i lithium-svovlbatterier opdaget med neutroneksperimentoperandocellen er udviklet hos HZB og gør det muligt at analysere processer inde i batteriet under opladningscyklusser med neutroner. Kredit:S. Risse/HZB Lithium-svovl-batterier betragtes som en a
Nanopartikler i lithium-svovlbatterier opdaget med neutroneksperimentoperandocellen er udviklet hos HZB og gør det muligt at analysere processer inde i batteriet under opladningscyklusser med neutroner. Kredit:S. Risse/HZB Lithium-svovl-batterier betragtes som en a -
 Vibration kun i én retningDet nydesignede materiale. Den transmitterer vibrationer fra venstre mod højre, men ikke fra højre mod venstre. Kredit:UvA/Brandenbourger et al. Elektroniske komponenter såsom transistorer transmi
Vibration kun i én retningDet nydesignede materiale. Den transmitterer vibrationer fra venstre mod højre, men ikke fra højre mod venstre. Kredit:UvA/Brandenbourger et al. Elektroniske komponenter såsom transistorer transmi -
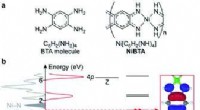 Forskere afdækker arbejdsprincipperne for et lovende materiale til hurtigopladning af batterier(a) Formler for BTA-molekyle og NiBTA og (b) elektronisk struktur af NiBTA. Den elektroniske struktur er opdelt i σ- og π-systemer. π-systemet dekomponeres yderligere i LMOer af Ni- og BTA-blokke. Tæt
Forskere afdækker arbejdsprincipperne for et lovende materiale til hurtigopladning af batterier(a) Formler for BTA-molekyle og NiBTA og (b) elektronisk struktur af NiBTA. Den elektroniske struktur er opdelt i σ- og π-systemer. π-systemet dekomponeres yderligere i LMOer af Ni- og BTA-blokke. Tæt -
 Lysemitterende elektrokemiske celler til genanvendelig belysningKredit:Technical University München En lavpris og let at fremstille lysteknologi kan fremstilles med lys-emitterende elektrokemiske celler. Sådanne celler er tyndfilm elektroniske og ioniske enhede
Lysemitterende elektrokemiske celler til genanvendelig belysningKredit:Technical University München En lavpris og let at fremstille lysteknologi kan fremstilles med lys-emitterende elektrokemiske celler. Sådanne celler er tyndfilm elektroniske og ioniske enhede
- Hvilke produkter af teknologi er muliggjort gennem fysik?
- Er det en myte, at øjet bliver beskadiget, hvis du ser på solen under solformørkelse?
- På himlen er der to planeter i nærheden af Moon, hvad er de?
- Hvad er et eksempel på et milligram?
- Videnskaben om spin - asteroseismologer bekræfter, at ældre stjerner roterer hurtigere end forvent…
- Behandlet hydraulisk fraktureringsspildevand kan forurene områdets vandkilder i årevis


