Hvad er det grundlæggende ved binding i en havelektroner?
1. Delokaliserede elektroner:
* I metalliske elementer er de yderste elektroner meget løst bundet til atomerne.
* Disse elektroner er ikke forbundet med noget særligt atom og er frie til at bevæge sig gennem hele metalgitteret.
* Dette "hav" af delokaliserede elektroner fungerer som en "lim", der holder de positivt ladede metalioner sammen.
2. Elektrostatisk tiltrækning:
* De positivt ladede metalioner tiltrækkes af det negativt ladede elektronhav.
* Denne stærke elektrostatiske attraktion er den primære kraft, der er ansvarlig for bindingen i metaller.
3. Egenskaber ved metallisk binding:
* Høj elektrisk ledningsevne: De delokaliserede elektroner kan let flyde gennem metallet, hvilket gør det til en fremragende leder af elektricitet.
* Høj termisk ledningsevne: De frie elektroner kan hurtigt overføre varmeenergi gennem metallet.
* formbarhed og duktilitet: Metaller kan hamres i ark (formbare) eller tegnes i ledninger (duktil), fordi lagene af atomer kan glide forbi hinanden uden at bryde de metalliske bindinger.
* Luster: Metaller har et skinnende udseende på grund af interaktion mellem lys og de delokaliserede elektroner.
4. Eksempler:
* Alle metaller, såsom guld, kobber, jern, aluminium og natrium, udviser metallisk binding.
Nøglepunkter:
* Metallisk binding er en unik type binding, der forekommer specifikt i metaller.
* "Hav" af delokaliserede elektroner er afgørende for metallers egenskaber.
* Den stærke elektrostatiske attraktion mellem elektronhavet og metalionerne er grundlaget for denne binding.
Sidste artikelHvad er polycarbonatpåvirkningsmodstand?
Næste artikelHvad er eksempler på termisk ekspansion en væske?
 Varme artikler
Varme artikler
-
 Kemiske ingeniører udgiver papir udfordrende teorier om glasovergangTermiske signaturer for en ultrastabil amorf teflon. (A) Varmestrøm versus temperatur for en 675 nm tyk VPD amorf teflonfilm ved forskellige afkølingshastigheder. (B) Logaritme af afkølingshastighed v
Kemiske ingeniører udgiver papir udfordrende teorier om glasovergangTermiske signaturer for en ultrastabil amorf teflon. (A) Varmestrøm versus temperatur for en 675 nm tyk VPD amorf teflonfilm ved forskellige afkølingshastigheder. (B) Logaritme af afkølingshastighed v -
 En grøn tilgang til fremstilling af ammoniak kunne hjælpe med at brødføde verdenKredit:UCF:Karen Norum Et UCF-forskerhold med samarbejdspartnere ved Virginia Tech har udviklet en ny grøn tilgang til fremstilling af ammoniak, der kan hjælpe med at gøre fodring af den stigende
En grøn tilgang til fremstilling af ammoniak kunne hjælpe med at brødføde verdenKredit:UCF:Karen Norum Et UCF-forskerhold med samarbejdspartnere ved Virginia Tech har udviklet en ny grøn tilgang til fremstilling af ammoniak, der kan hjælpe med at gøre fodring af den stigende -
 Ny indsigt i rotavirusmekanik kan føre til forbedrede behandlingerKunstnerisk gengivelse af rotaviruspartikeldissektionsprocessen, udført med atomkraftmikroskopi. Kredit:Billede skabt af Scixel (scixel.es/), under instruktionerne af D. Luque og P. J. de Pablo. F
Ny indsigt i rotavirusmekanik kan føre til forbedrede behandlingerKunstnerisk gengivelse af rotaviruspartikeldissektionsprocessen, udført med atomkraftmikroskopi. Kredit:Billede skabt af Scixel (scixel.es/), under instruktionerne af D. Luque og P. J. de Pablo. F -
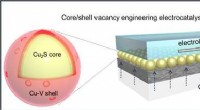 Ny katalysator opgraderer kuldioxid til fundne brændstofferCore/shell-vacancy engineering (CSVE) katalysator muliggør effektiv elektrokemisk reduktion af CO 2 til multi-carbon alkoholer. Kredit:ZHUANG Taotao Flydende multi-carbon alkoholer såsom ethanol
Ny katalysator opgraderer kuldioxid til fundne brændstofferCore/shell-vacancy engineering (CSVE) katalysator muliggør effektiv elektrokemisk reduktion af CO 2 til multi-carbon alkoholer. Kredit:ZHUANG Taotao Flydende multi-carbon alkoholer såsom ethanol
- Ny kvantealgoritme løser kritiske kvantekemiproblemer gennem tilpasning langs en geometrisk vej
- Hvad er forskellene mellem den relative og absolutte alder af klippelag?
- Hvor godt fungerer solceller egentlig i det nordiske klima?
- Hvilken type ledning bruges på steder med meget høje temperaturer, såsom elektriske varmelegemer?…
- Fiat Chryslers bestyrelse mødes i lyset af administrerende direktørs operation
- Hvordan vil solenergi hjælpe fremtiden?


