Hvad er varme på et molekylært niveau?
* kinetisk energi: Dette er bevægelsesenergien. Molekyler bevæger sig konstant, vibrerer og roterer. Jo hurtigere de bevæger sig, jo mere kinetisk energi har de.
* gennemsnit: Ikke alle molekyler i et stof bevæger sig med samme hastighed. Nogle vil bevæge sig hurtigere end andre. Varme måler den gennemsnitlige kinetiske energi for alle molekyler.
* Stof: Dette henviser til ethvert materiale, som luft, vand, metal osv.
Her er, hvordan varme påvirker molekyler:
* Øget varme: Når du tilføjer varme til et stof, øges den gennemsnitlige kinetiske energi af molekylerne. De bevæger sig hurtigere, vibrerer stærkere og roterer hurtigere. Dette kan føre til:
* udvidelse: Molekylerne tager mere plads, hvilket får stoffet til at udvide sig.
* statsændring: Tilsætning af nok varme kan forårsage en ændring i stoftilstanden (fast til væske, væske til gas). Dette sker, fordi molekylerne får nok energi til at bryde fri fra deres bindinger.
* Nedsat varme: Når du fjerner varmen fra et stof, falder den gennemsnitlige kinetiske energi af molekylerne. De bevæger sig langsommere, vibrerer mindre og roterer langsommere. Dette kan føre til:
* sammentrækning: Molekylerne tager mindre plads, hvilket får stoffet til at sammentrække.
* statsændring: Fjernelse af nok varme kan forårsage en ændring i stoftilstanden (gas til væske, væske til fast). Dette sker, fordi molekylerne mister energi og er mere tilbøjelige til at binde sammen.
Kort sagt: Varme er et mål for den gennemsnitlige energi fra molekylær bevægelse. Det er et grundlæggende koncept, der forklarer, hvordan stoffer opfører sig, når de opvarmes eller afkøles.
Sidste artikelHvad betyder med termoluminescens?
Næste artikelEr lipider fattige varmeledere?
 Varme artikler
Varme artikler
-
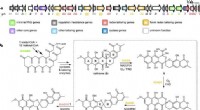 Nøgleenzymer til syntetisering af naturlige produkterOversigt over den foreslåede biosyntese af bakterielle rubromycin-type polyketider og endelige pathway-produkter. Kredit: Naturkommunikation (2021). DOI:10.1038/s41467-021-21432-9 Planter, svampe
Nøgleenzymer til syntetisering af naturlige produkterOversigt over den foreslåede biosyntese af bakterielle rubromycin-type polyketider og endelige pathway-produkter. Kredit: Naturkommunikation (2021). DOI:10.1038/s41467-021-21432-9 Planter, svampe -
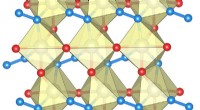 Ekstremt hårdt, men metallisk ledende:Forskere udvikler nyt materiale med højteknologiske udsigterStrukturen af rheniumnitridpernitrid indeholdende enkelte nitrogenatomer (rød) og N-N nitrogenhåndvægte (blå). Større kugler viser rheniumatomer. Kredit:Maxim Byko En international forskergruppe
Ekstremt hårdt, men metallisk ledende:Forskere udvikler nyt materiale med højteknologiske udsigterStrukturen af rheniumnitridpernitrid indeholdende enkelte nitrogenatomer (rød) og N-N nitrogenhåndvægte (blå). Større kugler viser rheniumatomer. Kredit:Maxim Byko En international forskergruppe -
 Surrey bygger AI til at finde kemiske forbindelser mod ældningKredit:CC0 Public Domain University of Surrey har opbygget en kunstig intelligens (AI) model, der identificerer kemiske forbindelser, der fremmer sund aldring - og baner vejen mod farmaceutiske in
Surrey bygger AI til at finde kemiske forbindelser mod ældningKredit:CC0 Public Domain University of Surrey har opbygget en kunstig intelligens (AI) model, der identificerer kemiske forbindelser, der fremmer sund aldring - og baner vejen mod farmaceutiske in -
 Opdeling og vækst af syntetiske vesiklerKredit:Wiley En stor udfordring for produktionen af syntetiske celler er, at de skal kunne dele sig for at få afkom. I journalen Angewandte Chemie , et team fra Heidelberg har nu introduceret
Opdeling og vækst af syntetiske vesiklerKredit:Wiley En stor udfordring for produktionen af syntetiske celler er, at de skal kunne dele sig for at få afkom. I journalen Angewandte Chemie , et team fra Heidelberg har nu introduceret
- Høj termoelektrisk ydeevne i billige SnS0.91Se0.09-krystaller
- Hvilke fordele ville du have, hvis du har bygget et observatorium på måneoverfladen?
- Hvilket grundstof ville reagere mest som calcium (ca)?
- Sådan slettes matricer på en TI-84
- Hvad er Silver II -nitrat?
- Planter og dyrtilpasninger i tempererede skove


