Hvad er de kinetiske egenskaber ved LDH?
kinetiske egenskaber ved lactatdehydrogenase (LDH)
Laktatdehydrogenase (LDH) er et allestedsnærværende enzym, der katalyserer den reversible interkonversion af pyruvat og laktat ved anvendelse af NADH/NAD+ som en cofaktor. Dens kinetiske egenskaber er afgørende for at forstå dens rolle i cellulær metabolisme.
Her er en sammenbrud af de vigtigste kinetiske egenskaber ved LDH:
1. Michaelis-Menten Kinetics:
* LDH følger Michaelis-Menten Kinetics, hvilket betyder, at dens reaktionshastighed øges med substratkoncentrationen, indtil det når et plateau, der repræsenterer den maksimale hastighed (Vmax).
* Michaelis -konstanten (KM) repræsenterer den substratkoncentration, hvor reaktionshastigheden er halvdelen af Vmax. En lavere KM indikerer en højere affinitet af enzymet for underlaget.
2. Substratspecificitet:
* LDH udviser bred substratspecificitet og accepterer en række pyruvatanaloger.
* Det foretrækker imidlertid pyruvat som et substrat til den fremadgående reaktion (pyruvat til lactat) og laktat til den omvendte reaktion (laktat til pyruvat).
3. Kofaktorafhængighed:
* LDH kræver NADH for reduktion af pyruvat til laktat og NAD+ for oxidation af laktat til pyruvat.
* Enzymets affinitet for NADH er højere end for NAD+, hvilket afspejler dens rolle i at reducere pyruvat under anaerobe forhold.
4. PH -afhængighed:
* LDH -aktivitet er optimal ved en let alkalisk pH (~ 8,5), hvilket afspejler den fysiologiske pH for cytosolen.
5. Temperaturafhængighed:
* LDH -aktivitet øges med temperaturen indtil et optimalt punkt, hvorefter den falder på grund af protein -denaturering.
6. Inhibering:
* LDH kan hæmmes af forskellige forbindelser, herunder:
* oxaloacetat: En konkurrencedygtig hæmmer af den fremadgående reaktion.
* pyruvat: En ikke-konkurrencedygtig hæmmer af den omvendte reaktion.
* tungmetaller: Inhiberer LDH -aktivitet gennem kompleksation med aktive stedrester.
7. Isozymer:
* LDH eksisterer som fem forskellige isozymer, der hver er sammensat af fire underenheder.
* Disse isozymer adskiller sig i deres kinetiske egenskaber, især deres tilknytning til pyruvat og laktat, og deres følsomhed over for hæmmere.
* Forskellige væv udtrykker forskellige LDH -isozymer, hvilket afspejler deres specifikke metaboliske behov.
8. Allosterisk regulering:
* LDH vides ikke at være reguleret af allosteriske mekanismer. Imidlertid påvirkes dens aktivitet af de relative koncentrationer af dens substrater og produkter samt tilgængeligheden af NADH og NAD+.
At forstå de kinetiske egenskaber ved LDH er vigtig for:
* analyse af metaboliske veje: LDH spiller en central rolle i kulhydratmetabolismen, og dets kinetiske egenskaber påvirker hastighederne for glycolyse og glukoneogenese.
* diagnosticering af sygdomme: Forskellige LDH -isozymmønstre er forbundet med forskellige sygdomme, hvilket muliggør diagnostisk test.
* Udvikling af nye terapier: Forståelse af LDH -kinetik er afgørende for udviklingen af medikamenter, der er målrettet mod dette enzym, især til behandling af kræft og metaboliske lidelser.
Bemærk: Denne information giver en generel oversigt over LDH -kinetik. Specifikke detaljer kan variere afhængigt af isozymet, de eksperimentelle forhold og den specifikke anvendelse.
Sidste artikelHvad sker der med volumenet af et stof, når det afkøles?
Næste artikelHvad er marken med densitet?
 Varme artikler
Varme artikler
-
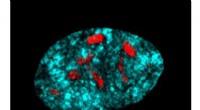 Beskyttelse af ribosomgener for at forhindre aldringI mangel af SIRT7, en menneskelig primærcelle viser flere nucleoli. DNA blev farvet med DAPI (turkis), og nucleolus blev farvet med anti-fibrillarin (rød). Kredit:Silvana Paredes Aldring er en pro
Beskyttelse af ribosomgener for at forhindre aldringI mangel af SIRT7, en menneskelig primærcelle viser flere nucleoli. DNA blev farvet med DAPI (turkis), og nucleolus blev farvet med anti-fibrillarin (rød). Kredit:Silvana Paredes Aldring er en pro -
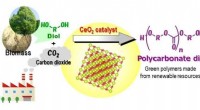 Verdens første grønne syntese af plast fra CO2Direktør 2 katalyserer den direkte polymerisation af flow CO 2 og dioler til tilvejebringelse af polycarbonatdioler i høje udbytter, som er nyttige kemikalier til polyestere, polyurethaner, og akr
Verdens første grønne syntese af plast fra CO2Direktør 2 katalyserer den direkte polymerisation af flow CO 2 og dioler til tilvejebringelse af polycarbonatdioler i høje udbytter, som er nyttige kemikalier til polyestere, polyurethaner, og akr -
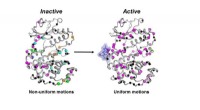 Enzymbevægelse kan være nøglen til nye kræftlægemidlerDen inaktive form (venstre) af MAPK p38-enzymet bevæger sig på en ukoordineret måde. Når de nødvendige molekyler (blå klat og P-symboler) binder, enzymet bliver aktivt (til højre) ved at bevæge sig på
Enzymbevægelse kan være nøglen til nye kræftlægemidlerDen inaktive form (venstre) af MAPK p38-enzymet bevæger sig på en ukoordineret måde. Når de nødvendige molekyler (blå klat og P-symboler) binder, enzymet bliver aktivt (til højre) ved at bevæge sig på -
 Skaber bomuld, der er brandsikkert og behageligtOmkostningseffektiv:Sabyasachi Gaan bruger damp fra en kommerciel trykkoger til at flammehæmme prøver af bomuldsstof. Kredit:Empa Avancerede flammehæmmende bomuldstekstiler lider under frigivelse
Skaber bomuld, der er brandsikkert og behageligtOmkostningseffektiv:Sabyasachi Gaan bruger damp fra en kommerciel trykkoger til at flammehæmme prøver af bomuldsstof. Kredit:Empa Avancerede flammehæmmende bomuldstekstiler lider under frigivelse
- Hvad betyder BC og AC i videnskaben?
- Forskere alkometerer køer for at måle metan-emissioner
- Hvad er formlen ammoniumhyposulfit?
- Den friktion, der opleves af en krop, når de er i bevægelse?
- I en maskine er arbejdsproduktionen mindre end input, fordi en eller anden energi konverteres til te…
- Hvordan sammenligner du og kontrasterer en ny måne med fuldmåne?


