Enzymbevægelse kan være nøglen til nye kræftlægemidler
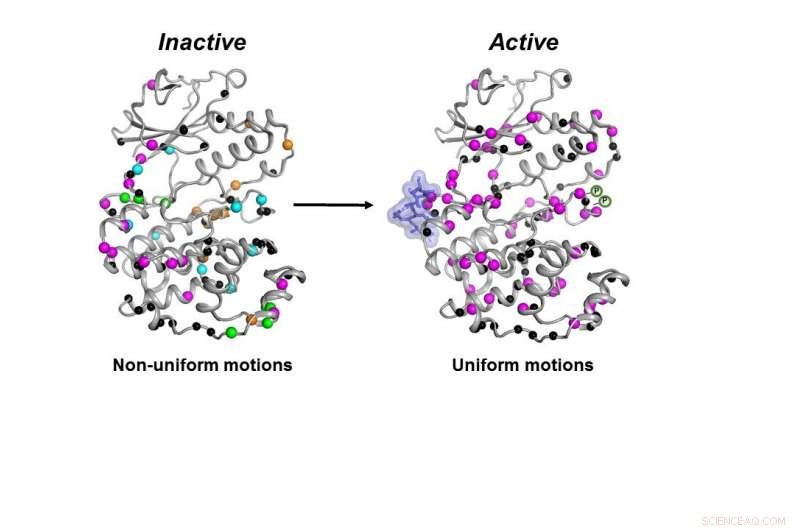
Den inaktive form (venstre) af MAPK p38-enzymet bevæger sig på en ukoordineret måde. Når de nødvendige molekyler (blå klat og P-symboler) binder, enzymet bliver aktivt (til højre) ved at bevæge sig på en koordineret måde for at udføre sit arbejde inde i en celle. Kredit:Senthil Ganesan, University of Arizona Institut for Kemi og Biokemi.
At afsløre alle de nødvendige trin for at aktivere et enzym kaldet en proteinkinase kan identificere nye måder at målrette mod kræft, ifølge ny University of Arizona-ledet forskning.
Ikke kun skal kinasen have alle nødvendige dele på plads, enzymet skal bevæge sig på den korrekte måde og med den korrekte hastighed for at fungere korrekt i en celle, fandt forskerne.
Første forfatter Senthil Kumar Ganesan, en UA forskningsassistent professor i kemi og biokemi, nævnte kinaser er switches, der slår visse cellulære processer til eller fra. Hvis en celles kinaser holdt op med at virke, cellen ville dø.
Det UA-ledede team er den første gruppe til at finde ud af den fulde vej til aktivering af en proteinkinase, sagde seniorforfatter Wolfgang Peti, som har Homer C. og Emily Davis Weed Endowed Chair i Kemi ved University of Arizona.
"Kinaser er et af de vigtigste kræftmedicinmål, " sagde Peti, som også er medlem af UA BIO5 Institute og UA Cancer Center. "Hvis du ved, hvordan en kinase virker, du kan helt sikkert bedre designe dine stoffer mod det."
At udvikle et lægemiddel, der udnytter dette nye forskningsresultat, vil sandsynligvis tage mindst 10 år, han sagde.
Kræftlægemidler, der allerede er i brug, og som målkinaser er dasatinib og imatinib til kronisk myeloid leukæmi og afatinib til ikke-småcellet lungekarcinom, sagde Ganesan.
For at se en kinase kaldet mitogen-aktiveret proteinkinase (MAPK) p38 i aktion, forskerne brugte nuklear magnetisk resonans (NMR) spektroskopi.
Alle nødvendige molekyler skulle binde sig til p38 for at enzymet blev aktivt. Først da kunne enzymet bevæge sig korrekt for at udføre sit arbejde i cellen, fandt forskerne.
"Vi fandt ud af, hvordan den bevæger sig for at udføre sit arbejde, og hvad er bidraget fra bevægelseshastighed til sit job, " sagde Peti.
Fundet tyder på, at en ny vej til at udvikle lægemidler mod kræft kunne skabe lægemidler, der forstyrrer p38s bevægelse, han sagde.
"Vi er begejstrede, fordi denne kinase tilhører en familie af kinaser, der kaldes MAP-kinaser - nøglesignalkinaser, der regulerer et væld af veje (inden for celler), " han sagde.
Peti sagde, at det nye fund muligvis gælder for andre kinaser. Han sagde, at de mange kinaseenzymer i kroppen er meget ens og sandsynligvis har lignende veje til aktivering.
Ganesan, Peti og deres medforfattere udgav papiret, "Dynamisk aktivering og regulering af den mitogenaktiverede proteinkinase p38, " i 1. maj-udgaven af Proceedings of the National Academy of Sciences .
Deres medforfattere er Michael W. Clarkson og Rebecca Page fra University of Arizona; Micha B. A. Kunze, Daniele Granata og Kresten Lindorff-Larsen fra Københavns Universitet i Danmark; og A. Joshua Wand fra University of Pennsylvania i Philadelphia.
National Institutes of Health tilskud NIH-R01GM100910 finansierede forskningen. Dataene blev indsamlet på UA Molecular Structures Core og Brown University Structural Biology Core faciliteter.
En ofte brugt analogi til, hvordan enzymer virker, er en lås og en nøgle. Et bestemt molekyle, nøglen, passer ind i et sted i enzymet, låsen. Når nøglen er i låsen, enzymet kan begynde at virke.
Nøglen i låsen er nødvendig for at et enzym kan virke, men det er ikke altid så nemt at aktivere et enzym. Nogle videnskabsmænd har foreslået, at dynamik - den måde og hastighed, hvormed et enzym bevæger sig - er vigtig for aktivering af kinaseenzymer.
Peti er interesseret i, hvordan molekyler såsom kinaser styrer processer med celler, så han ville undersøge den rolle, dynamikken spiller. At lære mere om, hvordan molekyler fungerer inde i celler, kan hjælpe med at udvikle målrettede lægemidler til at bekæmpe kræft og andre sygdomme.
At finde ud af, hvilken rolle dynamik spiller i aktiveringen af p38, var sværere og tog længere tid, end han forventede.
Værktøjet forskerne bruger til at se et enzym i aktion, NMR spektroskopi, er sværere med et stort molekyle som p38. Ud over, holdet skulle udvikle ny computersoftware til at analysere resultaterne, sagde Peti.
Forskerne så enzymet over en række trin, mens forskellige nøglemolekyler bandt til p38. Nogle enzymer bliver aktiveret, når nøglemolekyler binder - men ikke denne.
"Hvis du tror, det er en fem- eller seks-trins proces at gå fra nul til 100, vi troede, at ved trin nul, en, to eller tre, vi ville få indikationer eller retningslinjer, " sagde Peti.
Det skete ikke. Han sagde, at forskerne overvejede at give op.
"Intet virkede, og det så ud som om vores hypotese var fuldstændig forkert, " han sagde.
"Det, vi har, er, at der ikke sker noget fra nul til et, der sker ikke noget fra et til to, der sker ikke noget fra to til tre, der sker ikke noget fra tre til fire, " sagde Peti. "Når du går fra fire til fem:Bom! Pludselig var den der«.
Når alle disse trin var gennemført, selvom formen på p38 ikke ændrede sig, dens dynamik gjorde, sagde han - og at den endelige ændring i dynamikken var påkrævet for at enzymet kunne virke.
Holdets næste skridt, Peti sagde, er at se, om kinasernes bevægelse spiller en rolle ved diabetes.
 Varme artikler
Varme artikler
-
 Hit-to-lead undersøgelser af en ny serie af små molekyle inhibitorer af DHODHKredit:CC0 Public Domain Enzymet dihydroorotate dehydrogenase (DHODH), en væsentlig komponent for de novo pyrimidin-ribonukleotid-biosyntese, er genopstået i de sidste par år som et mål for udvikl
Hit-to-lead undersøgelser af en ny serie af små molekyle inhibitorer af DHODHKredit:CC0 Public Domain Enzymet dihydroorotate dehydrogenase (DHODH), en væsentlig komponent for de novo pyrimidin-ribonukleotid-biosyntese, er genopstået i de sidste par år som et mål for udvikl -
 Syv ting, der indikerer en kemisk ændring, skerGasbobler vises efter en kemisk reaktion, og blandingen bliver mættet med gas. Den kemiske ændring, der skaber gassen, afsluttes, efter at gasboblerne forlader blandingen. Eksempler på denne type r
Syv ting, der indikerer en kemisk ændring, skerGasbobler vises efter en kemisk reaktion, og blandingen bliver mættet med gas. Den kemiske ændring, der skaber gassen, afsluttes, efter at gasboblerne forlader blandingen. Eksempler på denne type r -
 Sådan bortskaffes methanolMethanol er en alkohol, der ofte bruges i laboratorieeksperimenter. Da det er brandfarligt og udgør sundhedsmæssige risici, er det vigtigt ikke at skylle methanol ned i drænet eller kombinere det med
Sådan bortskaffes methanolMethanol er en alkohol, der ofte bruges i laboratorieeksperimenter. Da det er brandfarligt og udgør sundhedsmæssige risici, er det vigtigt ikke at skylle methanol ned i drænet eller kombinere det med -
 De ultimative betingelser for at få mest muligt ud af høj-nikkel-batterierVirkningerne af lagring af omgivende luft på overfladen af NMC-811 Kredit:WMG, University of Warwick Det er almindeligt kendt inden for batterifremstilling, at mange katodematerialer er fugtføls
De ultimative betingelser for at få mest muligt ud af høj-nikkel-batterierVirkningerne af lagring af omgivende luft på overfladen af NMC-811 Kredit:WMG, University of Warwick Det er almindeligt kendt inden for batterifremstilling, at mange katodematerialer er fugtføls
- Top 5 bedste idéer til videnskabsmesse
- Klimaændringer vender en flodstrøm i canadisk gletsjer
- Amerikansk kryptoanarkist ser 3D-printede våben som en grundlæggende rettighed
- Nye spor om et uhåndgribeligt materiale:En superleder, der kan syntetiseres i laboratoriet
- En ny teori for, hvordan sorte huller og neutronstjerner skinner klart
- SpaceX sigter mod 3. besætnings lancering time før fredagens solopgang


