Forklar egenskaberne ved og forskelle mellem faste væsker gasser?
Stater med stof:faste stoffer, væsker og gasser
De tre primære tilstande med stof, faste stoffer, væsker og gasser differentieres med deres forskellige egenskaber, der stammer fra arrangementet og bevægelsen af deres bestanddele.
1. Faststoffer:
* form: Bestemt og fast.
* bind: Bestemt og fast.
* densitet: Høj på grund af tætpakkede partikler.
* Kompressibilitet: Meget lavt kan partikler ikke presses nærmere.
* Partikelarrangement: Meget bestilte, faste positioner i en gitterstruktur.
* Partikelbevægelse: Vibrerer om faste positioner.
Eksempler: Is, klippe, stål, træ
2. Væsker:
* form: Tager formen på sin beholder.
* bind: Bestemt, men kan ændres lidt med pres.
* densitet: Generelt mindre end faste stoffer, men højere end gasser.
* Kompressibilitet: Lidt komprimerbare kan partikler presses nærmere, men ikke signifikant.
* Partikelarrangement: Mindre bestilt end faste stoffer, men stadig tæt på hinanden.
* Partikelbevægelse: Flow forbi hinanden, men hold dig relativt tæt sammen.
Eksempler: Vand, olie, honning, kviksølv
3. Gasser:
* form: Tager formen på sin beholder.
* bind: Ubestemt udvides for at udfylde sin beholder.
* densitet: Meget lav på grund af vidt adskilte partikler.
* Kompressibilitet: Meget komprimerbare, partikler kan presses meget tættere sammen.
* Partikelarrangement: Tilfældig og bredt fordelt.
* Partikelbevægelse: Flyt frit i alle retninger, kolliderer ofte.
Eksempler: Luft, ilt, helium, kuldioxid
Forskelle og nøgleegenskaber:
| Ejendom | Solid | Væske | Gas |
| --- | --- | --- | --- |
| Form | Bestemt | Tager formen på container | Tager formen på container |
| Bind | Bestemt | Bestemt | Ubestemt |
| Densitet | Høj | Medium | Lav |
| Kompressibilitet | Lav | Let | Høj |
| Partikelarrangement | Bestilt, fast | Mindre bestilt, tæt sammen | Tilfældig, bredt fordelt |
| Partikelbevægelse | Vibrerer på plads | Flow forbi hinanden | Flyt frit i alle retninger |
Yderligere forskelle:
* diffusion: Gasser diffunderer meget hurtigere end væsker, og væsker diffunderer hurtigere end faste stoffer på grund af den større bevægelsesfrihed i gasser.
* overfladespænding: Væsker har en overfladespænding på grund af tiltrækningen mellem deres molekyler, hvilket får dem til at danne dråber og modstå deformation. Faststoffer udviser ikke overfladespænding.
Overgang mellem stater:
Stofstilstanden kan ændres på grund af ændringer i temperatur og tryk. F.eks. Gør opvarmning af is (fast) den til vand (væske), og yderligere opvarmning gør det til damp (gas).
Key Takeaway:
Forskellene mellem faste stoffer, væsker og gasser bestemmes primært af arrangementet og bevægelsen af deres bestanddele. Disse forskelle manifesterer sig i deres fysiske egenskaber, såsom form, volumen, densitet og kompressibilitet.
 Varme artikler
Varme artikler
-
 Forskere skaber kemiske haver, der kan bruges som knogleerstatningsmaterialerKredit:CC0 Public Domain En ny måde at fremstille knogleerstatningsmaterialer på, der gør det muligt for celler at vokse omkring og inde i dem, er blevet udviklet af forskere ved University of Bir
Forskere skaber kemiske haver, der kan bruges som knogleerstatningsmaterialerKredit:CC0 Public Domain En ny måde at fremstille knogleerstatningsmaterialer på, der gør det muligt for celler at vokse omkring og inde i dem, er blevet udviklet af forskere ved University of Bir -
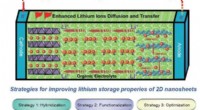 Regulering af todimensionelle nanomaterialer til lithium-ion-batterierStrategier til forbedring af lithiumlagringsegenskaberne for 2D nanoark. Kredit:©Science China Press Li-ion-batterier (LIBer) er fordelagtige energilagringsenheder på grund af deres højere specifi
Regulering af todimensionelle nanomaterialer til lithium-ion-batterierStrategier til forbedring af lithiumlagringsegenskaberne for 2D nanoark. Kredit:©Science China Press Li-ion-batterier (LIBer) er fordelagtige energilagringsenheder på grund af deres højere specifi -
 Forståelse af vands mærkelige adfærdEn clathrate is, med oxygener repræsenteret som kugler, og hydrogenbindinger som linier. Arbejdet har vist, hvordan komplekse krystallinske strukturer opstår som følge af vands interaktioner. Kredit:U
Forståelse af vands mærkelige adfærdEn clathrate is, med oxygener repræsenteret som kugler, og hydrogenbindinger som linier. Arbejdet har vist, hvordan komplekse krystallinske strukturer opstår som følge af vands interaktioner. Kredit:U -
 Opdagelse af afgiftningsenzym kunne bruges til at målrette mod større afgrødeforurenende stofferKredit:CC0 Public Domain Planter har udviklet afgiftningsforsvarssystemer som beskyttelse mod en række miljømæssige eller patogenproducerede forurenende stoffer. Sammenlignet med enzymer af primæ
Opdagelse af afgiftningsenzym kunne bruges til at målrette mod større afgrødeforurenende stofferKredit:CC0 Public Domain Planter har udviklet afgiftningsforsvarssystemer som beskyttelse mod en række miljømæssige eller patogenproducerede forurenende stoffer. Sammenlignet med enzymer af primæ
- Hvordan bevæger vand sig igennem og på toppen af stenjordlag?
- Hvad er de forskellige jordtyper, der findes i Haiti?
- Er der produceret noget affald fra geotermisk energi?
- MIT undersøgelse spørger:Er BlackBerry lig med 'CrackBerry' eller karriere afgørende?
- Hvad gør fugle så smarte?
- Grundvandsopladningshastigheder kortlagt for Afrika


