Når kræfter, der tiltrækker opløsningsmiddelpartikler til hinanden, er brudt, hvad leveres der til en løsning?
Her er hvorfor:
* opløsningsmiddel-opløsningsmiddelinteraktioner: Opløsningsmiddelmolekyler holdes sammen af intermolekylære kræfter (som hydrogenbinding, dipol-dipolinteraktioner eller London-spredningskræfter). Disse kræfter kræver energi til at overvinde.
* Breaking Bonds =Energiindgang: For at opløse et opløst stof, skal opløsningsmiddelmolekyler gå i stykker for at skabe plads til opløste partikler. Denne brud på opløsningsmiddel-opløsningsmiddelinteraktioner kræver energiindgang, typisk i form af varme.
* Løsningsdannelse: Energiindgangen hjælper med at overvinde de attraktive kræfter mellem opløsningsmiddelmolekylerne, hvilket gør det muligt for opløsningen at interagere med opløsningsmidlet og danne en opløsning.
Tænk på det på denne måde: Forestil dig at prøve at skubbe en gruppe mennesker tæt pakket sammen. Det ville kræve en vis indsats (energi) at adskille dem og give plads for en anden til at deltage i gruppen. Det samme princip gælder for opløsningsmiddelmolekyler og opløst et opløst stof.
Sidste artikelHvordan er et volumengastermometer OWRK?
Næste artikelForklar egenskaberne ved og forskelle mellem faste væsker gasser?
 Varme artikler
Varme artikler
-
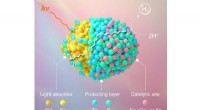 Voksende aktive steder på kvanteprikker til robust brintfotogenereringSkematisk diagram over sted- og rumligt-selektiv integration af metalioner i QDer for robust H 2 fotogenerering. Kredit:Prof. WUs Group For ganske nylig, Kinesiske forskere havde opnået sted- og
Voksende aktive steder på kvanteprikker til robust brintfotogenereringSkematisk diagram over sted- og rumligt-selektiv integration af metalioner i QDer for robust H 2 fotogenerering. Kredit:Prof. WUs Group For ganske nylig, Kinesiske forskere havde opnået sted- og -
 Forskere tilføjer orden til polymergelerEn prøve af den nye homogene polymergel. Kredit:© 2019 Li et al. Gel-lignende materialer har en lang række anvendelser, især inden for kemi og medicin. Imidlertid, deres anvendelighed er undertide
Forskere tilføjer orden til polymergelerEn prøve af den nye homogene polymergel. Kredit:© 2019 Li et al. Gel-lignende materialer har en lang række anvendelser, især inden for kemi og medicin. Imidlertid, deres anvendelighed er undertide -
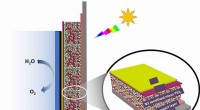 Lille titaniumbarriere stopper stort problem i brændstofproducerende solcellerIndkapsling af molekylkomponenterne i en solid-state farvestof-sensibiliseret solcelle ved en tynd tunnelspærre forbedrer dramatisk cellestabiliteten under vandspaltningsforhold (H2O til O2). Kredit:U
Lille titaniumbarriere stopper stort problem i brændstofproducerende solcellerIndkapsling af molekylkomponenterne i en solid-state farvestof-sensibiliseret solcelle ved en tynd tunnelspærre forbedrer dramatisk cellestabiliteten under vandspaltningsforhold (H2O til O2). Kredit:U -
 Hvad gør vin tør? Den er nem at smage, men meget sværere at måleEn masse kemi og fysik ligger bag, hvordan du opfatter en tår vin. Kredit:GANNA MARTYSHEVA/Shutterstock.com Når du tager en tår vin til et familiemåltid eller fest, hvad lægger du mærke til? Førs
Hvad gør vin tør? Den er nem at smage, men meget sværere at måleEn masse kemi og fysik ligger bag, hvordan du opfatter en tår vin. Kredit:GANNA MARTYSHEVA/Shutterstock.com Når du tager en tår vin til et familiemåltid eller fest, hvad lægger du mærke til? Førs


