Humanemembranproteiner opnår evolutionær balance
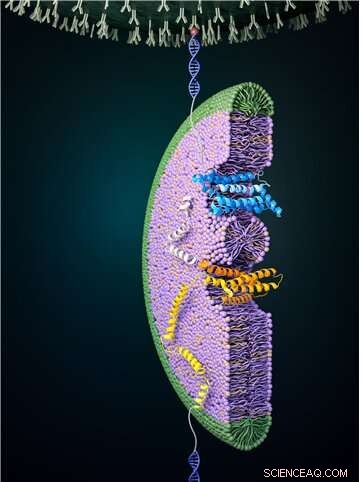
Figur 1:Foldeprocessen af en glukosetransportør ved hjælp af magnetisk pincet. En høj kraft påføres først for at afvikle proteinet fuldstændigt. Den påførte kraft sænkes derefter, hvilket gør det muligt at observere foldningsprocessen. På billedet kan en del af glukosetransportøren ses blive foldet for at danne en struktur og gå ind i bicellen (farvet blå). Denne foldningsproces forekommer ikke ofte uden ekstern assistance, så denne proces udføres ved hjælp af det omgivende membranmiljø og proteinkomplekser såsom EMC. Kredit:Seoul National University
Celler er opdelt af membraner, og proteiner til stede i disse membraner spiller en vigtig rolle i transport af cellulær information. For at disse proteiner fungerer korrekt, skal der dannes en tertiær proteinstruktur gennem den korrekte foldningsproces. I en undersøgelse offentliggjort i Nature Chemical Biology , foldningsprocessen af en glukosetransportør - et komplekst membranprotein - blev identificeret for første gang ved hjælp af en magnetisk pincet med et enkelt molekyle.
Ved at bruge det endoplasmatiske retikulum (ER) membranproteinkompleks (EMC) og et lipidmolekyle med en specifik struktur blev foldningsvejen for en glukosetransportør fuldt belyst i et fysiologisk miljø. Gennem bioinformatik blev det også opdaget, at membranproteinets strukturdannende evne og dets evne til at transportere glukose skulle have fundet en balance gennem hele dets evolutionære historie.
Selvom strukturerne af mange membranproteiner - inklusive glucosetransportere - allerede er blevet afsløret gennem de seneste fremskridt inden for strukturbiologi såsom kryo-elektronmikroskopi, forbliver den foldevej, hvori strukturerne af disse membranproteiner dannes, næsten fuldstændig ukendt. Tilbage i 2019 rapporterede forskerholdet i Science at foldningsvejene for membranproteiner kan afsløres ved hjælp af en magnetisk pincet, hvilket markerer første gang i verden, at foldningsvejen for et membranprotein blev afsløret.
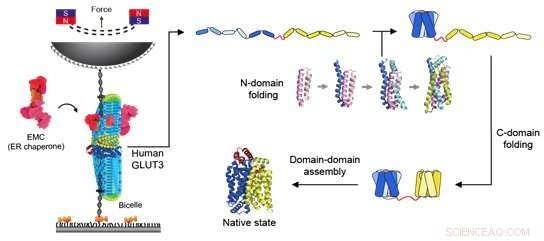
Figur 2:Skematisk diagram af magnetisk pincet og foldevejen for en glukosetransportør. Til venstre viser kraftanvendelsen på glukosetransportøren ved hjælp af magnetiske pincet. Biceller sammensat af forskellige lipidmolekyler blev leveret for at tilvejebringe et miljø, der kræves for, at membranproteiner kan fungere. Derudover blev EMC'er tilføjet for at hjælpe med at danne den korrekte tertiære proteinstruktur. Når den magnetiske perle trækkes mod den permanente magnet, påføres spænding til DNA-strengen forbundet med proteinet, og en konstant kraft påføres selve proteinet. Gennem dette eksperiment blev foldningsvejen for glucosetransporteren afsløret som vist på højre side af figuren. I den fuldt udfoldede tilstand af individuelle helixproteiner foldes N-domænet tæt på N-terminalen først for at opnå proteinets strukturdannende evne. Derefter, ved hjælp af EMC og et unikt formet lipidmolekyle, foldes C-domænet og til sidst kombineres de to domæner for at danne en funktionel tertiær proteinstruktur. Kredit:Seoul National University
Magnetisk pincet kan bruges til at påføre kraft til et enkelt protein og derved udfolde et proteins struktur fuldstændigt. Hvis den påførte kraft derefter sænkes, er det desuden muligt at observere processen med det frigivne protein, der genfolder sig tilbage til sin oprindelige foldede form (Figur 1,2).
Glucosetransporterproteiner er, som navnet antyder, en gruppe proteiner, der besidder en vej, som glucose kan passere igennem. Glucosetransportveje er funktionelt essentielle, men disse veje fungerer også som forhindringer i dannelsen af de tertiære strukturer af membranproteiner. Celler har forskellige hjælpere til at løse disse vanskeligheder. I denne undersøgelse blev det fundet, at EMC - en type proteinchaperon - såvel som unikt strukturerede lipidmolekyler arbejder sammen med at hjælpe glukosetransportøren i dens strukturdannelse.
Figur 3:Fylogenetisk analyse for forskellige sukkertransportører. Bioinformatik blev brugt til at analysere sekvensen af GLUT3 såvel som andre evolutionært relaterede sukkertransportproteiner. I alt 143 proteiner blev analyseret og præsenteret som et fylogenetisk træ som vist i figuren til venstre. Sekvensen af sukkertransportproteinet fra metazoer inklusive Homo sapiens blev analyseret nøje som vist til højre. Ved at kombinere disse data med informationen observeret på foldningsvejen opnået gennem magnetisk pincet, blev det afsløret, at den strukturdannende evne af membranproteiner og deres evne til at transportere sukker effektivt begge udviklede sig gennem en evolutionær balance. Kredit:Seoul National University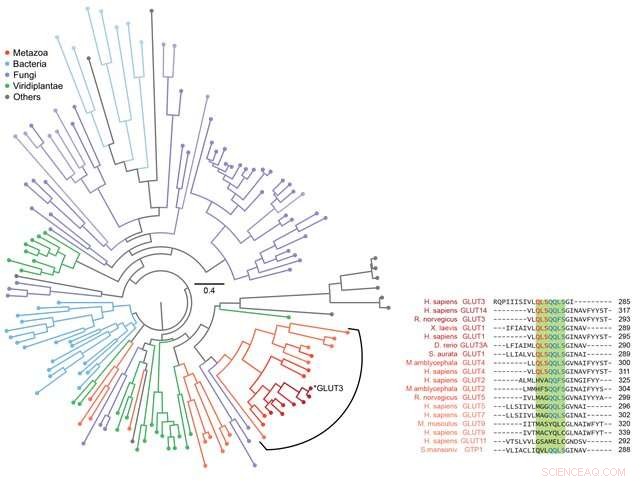
Lab finder nye niveauer af detaljer om nøglemembranproteiner
Sidste artikelKemikere HAT-trick til grønnere kemisk syntese
Næste artikelSådan binder du bomuld med agern og rust
 Varme artikler
Varme artikler
-
 Programmering af syntetiske molekylære koder for at tænde generEn syntetisk molekylær kode kaldet Bi-PIP er blevet designet, som omfatter en hæmmer af et epigenetisk læserbromodæne og selektive DNA-bindende pyrrol-imidazolpolyamider. Bi-PIPet skrev en biomimetisk
Programmering af syntetiske molekylære koder for at tænde generEn syntetisk molekylær kode kaldet Bi-PIP er blevet designet, som omfatter en hæmmer af et epigenetisk læserbromodæne og selektive DNA-bindende pyrrol-imidazolpolyamider. Bi-PIPet skrev en biomimetisk -
 Forskere udvikler en ny raman-spektroskopiplatform til at karakterisere IDP'er i fortyndet opløsnin…En illustration, der viser det optiske pincet-kontrollerede hotspot til proteinstrukturkarakteriseringen ved overfladeforstærket Raman-spektroskopi. Kredit:Vince St. Dollente Mesias, Jinqing Huang / H
Forskere udvikler en ny raman-spektroskopiplatform til at karakterisere IDP'er i fortyndet opløsnin…En illustration, der viser det optiske pincet-kontrollerede hotspot til proteinstrukturkarakteriseringen ved overfladeforstærket Raman-spektroskopi. Kredit:Vince St. Dollente Mesias, Jinqing Huang / H -
 Første detaljerede kig på afgørende enzym fremmer kræftforskningenPetra Fromme er direktør for Biodesign Center for Applied Structural Discovery. Hun er også Regents Professor ved ASUs School of Molecular Sciences. Kredit:Biodesign Institute ved Arizona State Univer
Første detaljerede kig på afgørende enzym fremmer kræftforskningenPetra Fromme er direktør for Biodesign Center for Applied Structural Discovery. Hun er også Regents Professor ved ASUs School of Molecular Sciences. Kredit:Biodesign Institute ved Arizona State Univer -
 Ny symmetri-brydende metode åbner vej for bioaktive forbindelserEn demonstration af molekylær chiralitet ved hjælp af 3-D atommodeller i laboratoriet. Kredit:J. Waser/EPFL Mange kemiske molekyler kan eksistere i naturen sammen med deres spejlmodstykker; som hæ
Ny symmetri-brydende metode åbner vej for bioaktive forbindelserEn demonstration af molekylær chiralitet ved hjælp af 3-D atommodeller i laboratoriet. Kredit:J. Waser/EPFL Mange kemiske molekyler kan eksistere i naturen sammen med deres spejlmodstykker; som hæ
- Straffen for familieejet franchise
- Efterhånden som elektronik krymper til nanoskala, vil de stadig være gode som guld?
- iOS 12 har en cool ny funktion - et målebånd til din mobiltelefon
- Definition af brutto og fin motorisk færdigheder
- Farer for Savanna-økosystemet
- Forskere vurderer, at Mælkevejens masse er 890 milliarder gange vores sols


