Hvor solide ændrer sig til flydende gas?
1. Solid til væske:smeltning
* Hvad sker der: Når en solid absorberer nok energi (normalt i form af varme), begynder dens partikler at vibrere hurtigere og bryde fri fra deres faste positioner.
* Resultatet: Den solide struktur bryder sammen, og partiklerne kan bevæge sig mere frit og danne en væske.
2. Væske til gas:Fordampning/kogning
* Hvad sker der: Når en væske fortsætter med at absorbere varme, får dens partikler endnu mere energi.
* Resultatet: Partiklerne bevæger sig så hurtigt, at de overvinder de attraktive kræfter, der holder dem sammen og slipper ud i luften som gasmolekyler. Dette kan ske gradvist gennem fordampning eller hurtigt gennem kogning , hvor væsken når en specifik temperatur (kogepunkt).
Nøglepunkter:
* Temperatur: Varme er den energi, der driver faseændringer. Jo højere temperatur, jo mere energi har partiklerne.
* tryk: Presset spiller også en rolle. Højere tryk gør det sværere for partikler at flygte ind i gasfasen.
* Intermolekylære kræfter: Styrken af kræfterne, der holder partikler sammen i en fast eller væske, påvirker, hvor meget energi der er behov for for at ændre faser.
Eksempler:
* is (fast) smelter i vand (væske)
* vand (væske) kogning i damp (gas)
Fortæl mig, hvis du gerne vil have flere detaljer om specifikke faseændringer eller ønsker at udforske videnskaben bag dem yderligere!
Sidste artikelEr brom en god leder af varme og elektricitet?
Næste artikelHvad er de tre naturlige fænomener, der understøtter kinetisk?
 Varme artikler
Varme artikler
-
 En dag til at fejre kemiens yndlingsenhed - muldvarpen. Men hvad er en muldvarp?Mole Day er en uofficiel helligdag, der fejres blandt kemikere den 23. oktober, mellem 6:02 og 18:02. Tid og dato er afledt af Avogadros nummer. Kredit:Ekaterina_Minaeva/Shutterstock.com Den 23. o
En dag til at fejre kemiens yndlingsenhed - muldvarpen. Men hvad er en muldvarp?Mole Day er en uofficiel helligdag, der fejres blandt kemikere den 23. oktober, mellem 6:02 og 18:02. Tid og dato er afledt af Avogadros nummer. Kredit:Ekaterina_Minaeva/Shutterstock.com Den 23. o -
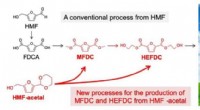 Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli
Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli -
 Kubeformede jern-svovl-klynger understøtter multiple bindinger mellem jern og nitrogenKredit:Wiley I en række biologiske processer, jern-svovlklynger spiller en afgørende rolle, hvor de fungerer som cofaktorer til enzymer. Forskning offentliggjort i Angewandte Chemie viser nu, at
Kubeformede jern-svovl-klynger understøtter multiple bindinger mellem jern og nitrogenKredit:Wiley I en række biologiske processer, jern-svovlklynger spiller en afgørende rolle, hvor de fungerer som cofaktorer til enzymer. Forskning offentliggjort i Angewandte Chemie viser nu, at -
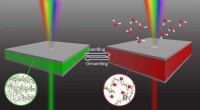 Smarte vinduer, der selvlyser på regnvejrsdageKredit:Pohang University of Science &Technology (POSTECH) Smarte vinduer, der automatisk skifter farver afhængigt af sollysets intensitet, får opmærksomhed, da de kan reducere energiregningen ved
Smarte vinduer, der selvlyser på regnvejrsdageKredit:Pohang University of Science &Technology (POSTECH) Smarte vinduer, der automatisk skifter farver afhængigt af sollysets intensitet, får opmærksomhed, da de kan reducere energiregningen ved
- Hvor mange atomer af ilt er der i 0,100 mol siliciumdioxid?
- 15 tilsyneladende simple spørgsmål, vi ikke kender svaret på
- Tysk spionagentur kan holde øje med internethubs:domstol
- Hvordan myrer, bier, og frugtfluer kan være den næste store sus inden for kunstig intelligens
- Hvad er Månen er flyttet mod øst i sin bane fra ny fase og danner en 90 graders vinkel med Sun Ear…
- Hvorfor brænder meteorer, når de først kommer ind i Jordens atmosfære?


