Er brom en god leder af varme og elektricitet?
Her er hvorfor:
* Matterilat: Brom er en væske ved stuetemperatur. Væsker er generelt dårligere ledere af varme og elektricitet end faste stoffer.
* atomstruktur: Brom er en ikke -metal. Ikke -metaller har en tendens til at holde fast i deres elektroner tæt, hvilket gør det vanskeligt for elektroner at bevæge sig frit og udføre elektricitet. De har også svage intermolekylære kræfter, som bidrager til dårlig varmeanlæg.
* Elektroner: Bromatomer har en relativt høj elektronegativitet, hvilket betyder, at de tiltrækker elektroner stærkt. Dette gør det vanskeligt for elektroner at bevæge sig frit, hvilket er nødvendigt for god ledningsevne.
I modsætning: Metaller er gode ledere af varme og elektricitet, fordi de har frie elektroner, der let kan bevæge sig i hele materialet.
Sidste artikelHar hexan nogen ikke -delte elektroner?
Næste artikelHvor solide ændrer sig til flydende gas?
 Varme artikler
Varme artikler
-
 En elektrolytdesignstrategi til fremstilling af divalente metalbatterierBatterielektrolytter, der anvender aminbaserede chelateringsmidler, der opløser divalente kationer, viste stabil og meget reversibel plettering/stripping af Mg-metal som illustreret ved scanningselekt
En elektrolytdesignstrategi til fremstilling af divalente metalbatterierBatterielektrolytter, der anvender aminbaserede chelateringsmidler, der opløser divalente kationer, viste stabil og meget reversibel plettering/stripping af Mg-metal som illustreret ved scanningselekt -
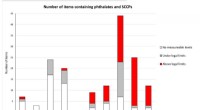 Toksiner i gammelt legetøj en hindring for cirkulær økonomiMange af det ældre legetøj indeholdt giftstoffer. Kredit:Göteborgs Universitet At lade børn lege med plastiklegetøj kan udgøre en sundhedsrisiko. Da forskere ved Gøteborgs Universitet testede en la
Toksiner i gammelt legetøj en hindring for cirkulær økonomiMange af det ældre legetøj indeholdt giftstoffer. Kredit:Göteborgs Universitet At lade børn lege med plastiklegetøj kan udgøre en sundhedsrisiko. Da forskere ved Gøteborgs Universitet testede en la -
 At lave tøj af mælkKredit:Piotr Łohunko I EU, beboere spilder anslået 88 millioner tons mad hvert år, ifølge de seneste skøn. Det er omkring 170 kg pr. person. Men hvad nu hvis videnskabsmænd kunne omdanne noget af
At lave tøj af mælkKredit:Piotr Łohunko I EU, beboere spilder anslået 88 millioner tons mad hvert år, ifølge de seneste skøn. Det er omkring 170 kg pr. person. Men hvad nu hvis videnskabsmænd kunne omdanne noget af -
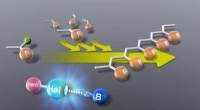 Fremstilling af fremtiden med en ny miljøvenlig polymeriseringsmetodeHalogenbindende organokatalysatorer (R-Hal-B) lettede jævn levende kationisk polymerisation af vinyl (R-Cl) monomerer ved stuetemperatur, producerer en god mængde rent udbytte, åbne døre for at opnå m
Fremstilling af fremtiden med en ny miljøvenlig polymeriseringsmetodeHalogenbindende organokatalysatorer (R-Hal-B) lettede jævn levende kationisk polymerisation af vinyl (R-Cl) monomerer ved stuetemperatur, producerer en god mængde rent udbytte, åbne døre for at opnå m
- Hvordan solens magnetiske kræfter arrangerer gaspartikler
- Et objekt, der rejser 250 m i 25s, har hvilken hastighed?
- Netværk med spøgelser i maskinen ... og talekedler
- Virtuel virkelighedsturné vækker liv i Jerusalem fra den bibelske æra
- Definer komplet forbrænding og skriv en kemisk ligning for metangas?
- Lagring af data i DNA bringer naturen ind i det digitale univers


