Hvordan siger molekyler sammen?
1. Van der Waals Forces:
* dipol-dipolinteraktioner: Forekommer mellem polære molekyler, hvor den ene ende af molekylet har en let positiv ladning, og den anden ende har en let negativ ladning. Disse modsatte anklager tiltrækker hinanden.
* London Dispersion Forces (LDFS): Dette er den svageste type intermolekylær kraft og findes mellem alle molekyler, endda ikke -polære. De stammer fra midlertidige udsving i elektronfordeling og skaber midlertidige dipoler.
* Hydrogenbinding: En speciel type dipol-dipolinteraktion, der opstår, når brint er bundet til et stærkt elektronegativt atom som ilt, nitrogen eller fluor. Dette skaber en stærk attraktion mellem brint og det ensomme par elektroner på det elektronegative atom i et andet molekyle.
2. Ioniske kræfter:
* ionisk binding: Dette forekommer mellem modsat ladede ioner. Disse kræfter er meget stærke og er ansvarlige for dannelsen af ioniske forbindelser.
3. Kovalente obligationer:
* Mens kovalente bindinger holder atomer sammen * inden for * et molekyle, bidrager de også til den samlede stabilitet af et molekyle. De delte elektroner i kovalente bindinger hjælper med at skabe en stærk, stabil struktur.
Det er vigtigt at huske:
* Styrken af intermolekylære kræfter afhænger af typen af molekyle og dens struktur.
* Svagere intermolekylære kræfter fører til lavere smelte- og kogepunkter, mens stærkere kræfter fører til højere smelte- og kogepunkter.
* Intermolekylære kræfter er ansvarlige for mange af de fysiske egenskaber ved stof, såsom viskositet, overfladespænding og opløselighed.
Tænk på intermolekylære kræfter som lille "lim", der holder molekyler sammen. Jo stærkere "lim", jo mere tæt molekylerne holdes, og jo sværere er det at adskille dem.
 Varme artikler
Varme artikler
-
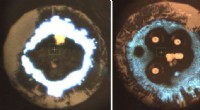 Forskere syntetiserer nyt nitrid og stabiliserer dets hexazinringe ved højt trykMikrofotografier af laseropvarmede kaliumazidprøver ved tryk på 500.000 atmosfærer (venstre) og 300.000 atmosfærer (højre). De hvide til lyseblå områder på ydersiden er K1N3. Mod midten er materialet
Forskere syntetiserer nyt nitrid og stabiliserer dets hexazinringe ved højt trykMikrofotografier af laseropvarmede kaliumazidprøver ved tryk på 500.000 atmosfærer (venstre) og 300.000 atmosfærer (højre). De hvide til lyseblå områder på ydersiden er K1N3. Mod midten er materialet -
 Solceller med nye grænsefladerKredit:CC0 Public Domain Forskere fra NUST MISIS (Rusland) og Tor Vergata-universitetet i Rom fandt ud af, at en mikroskopisk mængde todimensionalt titankarbid kaldet MXene forbedrer væsentligt op
Solceller med nye grænsefladerKredit:CC0 Public Domain Forskere fra NUST MISIS (Rusland) og Tor Vergata-universitetet i Rom fandt ud af, at en mikroskopisk mængde todimensionalt titankarbid kaldet MXene forbedrer væsentligt op -
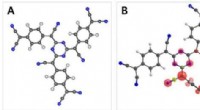 Organisk ferromagnetisme:Fældning spinder i den glasagtige tilstand af en organisk netværksstruktu…Et team af forskere, tilknyttet Sydkoreas Ulsan National Institute of Science and Technology (UNIST) præsenterer alternative metoder til alsidige fremtidige anvendelser af plastmagneter. Kredit:UNIST
Organisk ferromagnetisme:Fældning spinder i den glasagtige tilstand af en organisk netværksstruktu…Et team af forskere, tilknyttet Sydkoreas Ulsan National Institute of Science and Technology (UNIST) præsenterer alternative metoder til alsidige fremtidige anvendelser af plastmagneter. Kredit:UNIST -
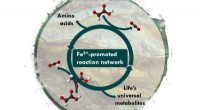 Lifes biokemiske netværk kunne have dannet sig spontant på JordenSyntese og nedbrydning af universelle metaboliske forstadier fremmet af jern Kredit:University of Strasbourg Forskere i Strasbourg, Frankrig, har fundet ud af at blande to små biomolekyler, glyoxy
Lifes biokemiske netværk kunne have dannet sig spontant på JordenSyntese og nedbrydning af universelle metaboliske forstadier fremmet af jern Kredit:University of Strasbourg Forskere i Strasbourg, Frankrig, har fundet ud af at blande to små biomolekyler, glyoxy
- Hvad er farveændringen, når kobberoxid tilsættes brint?
- Former skyer i stratosfæren?
- Er alle stjernerne i konstellation samme afstand væk fra os?
- Et spørgsmål om tyngdekraft - at forstå, hvordan planter vokser i rummet
- Momentum af et ikke -bevægende objekt?
- Hvad er to af de længste floder i Frankrig?


