Hvordan finder du massen af et atom med kun molær givet?
forståelse af forholdet
* molmasse: Den molære masse er massen af en mol af et stof (6,022 x 10^23 atomer eller molekyler). Det udtrykkes i gram pr. Mol (g/mol).
* atommasse: Atommassen (også kaldet atomvægt) er den gennemsnitlige masse af et atom af et element, udtrykt i atommasseenheder (AMU).
Forbindelsen
Nøglen er, at den numeriske værdi af den molære masse i gram pr. Mol er den * samme * som den numeriske værdi af atommassen i atommasseenheder.
eksempel
* Den molære masse af kulstof er 12,01 g/mol.
* Atommassen af kulstof er 12,01 amu.
at finde massen af et enkelt atom
For at finde massen af et enkelt atom skal du konvertere fra atommasseenheder (AMU) til gram:
1. konverter amu til gram: 1 amu =1.66054 x 10^-24 gram
2. Multiplicer atommassen (i AMU) med konverteringsfaktoren:
For eksempel ville massen af et enkelt carbonatom være:
12.01 amu * (1.66054 x 10^-24 gram/amu) =1,994 x 10^-23 gram
Vigtig note: Atommassen er et gennemsnit under hensyntagen til de forskellige isotoper af et element. Så massen af et enkelt atom kan variere lidt afhængigt af den specifikke isotop.
Sidste artikelHvilken type materialer fungerer i ledning?
Næste artikelHvad er brydningen for disse 2 materialer Germanium og Pyrex?
 Varme artikler
Varme artikler
-
 Robotblodhund sporer lugte på jordenKredit:American Chemical Society Blodhunde er berømte for deres evne til at spore dufte over store afstande. Nu har forskere udviklet en moderne blodhund - en robot, der hurtigt kan registrere lug
Robotblodhund sporer lugte på jordenKredit:American Chemical Society Blodhunde er berømte for deres evne til at spore dufte over store afstande. Nu har forskere udviklet en moderne blodhund - en robot, der hurtigt kan registrere lug -
 Forstå sprøde revner for at designe stærkere materialerKredit:CC0 Public Domain I et papir udgivet i Naturfysik , Northeastern University Department of Physics Arts and Sciences Distinguished Professor Alain Karma, i samarbejde med hans postdoktoral
Forstå sprøde revner for at designe stærkere materialerKredit:CC0 Public Domain I et papir udgivet i Naturfysik , Northeastern University Department of Physics Arts and Sciences Distinguished Professor Alain Karma, i samarbejde med hans postdoktoral -
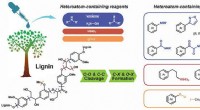 Varianter af funktionaliserede aromater ekspanderet ved heteroatom-deltaget lignin-spaltningHeteroatom-holdige reagenser udløser den katalytiske spaltning af ligninbindinger og funktionalisering af produkter samtidigt. Kredit:LI Hongji Lignin er det aromatiske polymerfragment af lignocel
Varianter af funktionaliserede aromater ekspanderet ved heteroatom-deltaget lignin-spaltningHeteroatom-holdige reagenser udløser den katalytiske spaltning af ligninbindinger og funktionalisering af produkter samtidigt. Kredit:LI Hongji Lignin er det aromatiske polymerfragment af lignocel -
 Massespektrometri kaster nyt lys over thalliumforgiftende cold caseHårprøver fra offeret monteres på objektglas til analyse ved massespektrometri. Kredit:Faye Levine I 1994, Den kinesiske universitetsstuderende Zhu Ling begyndte at opleve mavesmerter, hårtab og d
Massespektrometri kaster nyt lys over thalliumforgiftende cold caseHårprøver fra offeret monteres på objektglas til analyse ved massespektrometri. Kredit:Faye Levine I 1994, Den kinesiske universitetsstuderende Zhu Ling begyndte at opleve mavesmerter, hårtab og d
- Hvad gør et godt træ? Vi brugte AI til at spørge fugle
- Fysikere modeller og forudsigelser kan have anvendelse i den nye generation af superstrålende laser…
- Kan bruges til at beregne mængden af energi, der bruges af kroppen?
- Er denne erklæring sand eller falsk, en gruppe af forskellige organismer, der bor sammen i bestemte…
- Hvad var Johannes Kepler berømt for?
- Hvordan ændrede svigt i Michelson-Morley-eksperimentet videnskabelige teorier lys?


