Hvordan ændres bevægelsen af gasmolekyler?
1. Temperatur:
* Forøget temperatur: Molekyler bevæger sig hurtigere og kolliderer oftere og med større kraft. Dette øger den gennemsnitlige kinetiske energi af molekylerne, hvilket fører til et højere tryk.
* Nedsat temperatur: Molekyler bevæger sig langsommere og kolliderer sjældnere. Dette reducerer den gennemsnitlige kinetiske energi af molekylerne, hvilket fører til et lavere tryk.
2. Tryk:
* Øget pres: Molekyler tvinges tættere sammen, hvilket fører til hyppigere kollisioner og en højere gennemsnitlig kinetisk energi.
* Nedsat pres: Molekyler har mere plads til at bevæge sig, hvilket resulterer i færre kollisioner og lavere gennemsnitlig kinetisk energi.
3. Bind:
* øget volumen: Molekyler har mere plads til at bevæge sig, hvilket fører til færre kollisioner og en lavere gennemsnitlig kinetisk energi.
* Nedsat volumen: Molekyler tvinges tættere sammen, hvilket fører til hyppigere kollisioner og en højere gennemsnitlig kinetisk energi.
4. Molekylær masse:
* Højere molekylær masse: Molekyler bevæger sig langsommere ved en given temperatur på grund af deres større inerti.
* lavere molekylmasse: Molekyler bevæger sig hurtigere ved en given temperatur på grund af deres lavere inerti.
5. Intermolekylære kræfter:
* stærkere intermolekylære kræfter: Molekyler er mere tiltrukket af hinanden, hvilket fører til langsommere bevægelse og mindre hyppige kollisioner.
* svagere intermolekylære kræfter: Molekyler er mindre tiltrukket af hinanden, hvilket fører til hurtigere bevægelse og hyppigere kollisioner.
6. Faseændringer:
* gas til væske: Molekyler bremser, mister energi og kommer nærmere sammen.
* gas til fast: Molekyler bremser yderligere, mister mere energi og bliver arrangeret i en fast gitterstruktur.
Sammenfattende påvirkes bevægelsen af gasmolekyler af:
* Temperatur (direkte proportional med kinetisk energi)
* tryk (omvendt proportional med volumen)
* volumen (omvendt proportional med pres)
* molekylær masse (omvendt proportional med hastighed)
* Intermolekylære kræfter (påvirker kollisionsfrekvens og hastighed)
* faseændringer (fører til betydelige ændringer i molekylebevægelse)
At forstå, hvordan disse faktorer påvirker gasmolekylbevægelse, er afgørende for at forstå og forudsige gassens opførsel i forskellige scenarier.
Sidste artikelHvordan betragtes to partikler i fase?
Næste artikelEn kombination af to forskellige metaller, der er bundet sammen, kaldes A?
 Varme artikler
Varme artikler
-
 Forskere opfinder håndholdt enhed til hurtig overvågning af drikkevandskvalitetenNTU -forskere udviklede en bærbar enhed, inspireret af menneskekroppens evne, at opdage spor af tungmetaller i drikkevand på bare fem minutter. L-R:Assoc Prof Yong Ken-Tye og hans ph.d.-studerende Ste
Forskere opfinder håndholdt enhed til hurtig overvågning af drikkevandskvalitetenNTU -forskere udviklede en bærbar enhed, inspireret af menneskekroppens evne, at opdage spor af tungmetaller i drikkevand på bare fem minutter. L-R:Assoc Prof Yong Ken-Tye og hans ph.d.-studerende Ste -
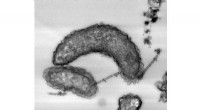 Jernætsende bakterier har vist sig at have enzymer, der gør dem i stand til at udvinde elektroner …Figur:Transmissionselektronmikroskopisk billede af ydre membrancytokromer under elektronkildemangel. Ydre membran (OM) Cytokromer blev farvet på celleoverfladen og nanotråde. Kredit:National Institute
Jernætsende bakterier har vist sig at have enzymer, der gør dem i stand til at udvinde elektroner …Figur:Transmissionselektronmikroskopisk billede af ydre membrancytokromer under elektronkildemangel. Ydre membran (OM) Cytokromer blev farvet på celleoverfladen og nanotråde. Kredit:National Institute -
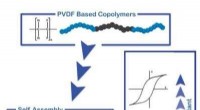 Ferroelektriske polymerer gjort mere alsidigeEn blokcopolymer af PVDF (sort) og en isolerende polymerkæde (blå) danner en blokcopolymer. Gennem faseadskillelse, blokkene samles i film. De dielektriske egenskaber kan indstilles ved at variere sam
Ferroelektriske polymerer gjort mere alsidigeEn blokcopolymer af PVDF (sort) og en isolerende polymerkæde (blå) danner en blokcopolymer. Gennem faseadskillelse, blokkene samles i film. De dielektriske egenskaber kan indstilles ved at variere sam -
 Elektronkrystallografi viste sig at virke lige så godt som røntgenkrystallografi kun på mindre kr…Identifikation af forbindelser fra heterogene blandinger. EM-gitter forberedt som ovenfor med biotin, brucine, carbamazepin, og cinchoninpulver blandet sammen. Alle fire forbindelser identificeret ved
Elektronkrystallografi viste sig at virke lige så godt som røntgenkrystallografi kun på mindre kr…Identifikation af forbindelser fra heterogene blandinger. EM-gitter forberedt som ovenfor med biotin, brucine, carbamazepin, og cinchoninpulver blandet sammen. Alle fire forbindelser identificeret ved
- Hvordan var atmosfæren i juraperioden?
- Adlyder alle netværk loven om skalafri? Måske ikke
- Stærkt skælv rammer Solomons; nogle skader, men ingen tsunami
- Hvad rejser langt ind i solsystemet, der indsamler information og returnerer det til jorden?
- Hvad er størrelsen af acceleration et objekt i frit fald nær overfladen?
- Genomanalyse afslører ukendt gammel menneskelig migration i Europa


