Hvad kan tilsættes til et atom forårsage et ikke -valenselektron i midlertidigt at blive valenselektron?
* Valenselektroner: Dette er elektronerne i den yderste skal af et atom. Det er dem, der mest sandsynligt er involveret i kemisk binding.
* Ikke-valenselektroner: Dette er elektronerne i indre skaller. De holdes typisk tæt på kernen og er mindre tilbøjelige til at deltage i binding.
Hvad kan påvirke et elektrons potentiale til at deltage i binding?
* excitation: Hvis et atom absorberer energi (som varme eller lys), kan en ikke-valenselektron fremmes til et højere energiniveau, hvilket potentielt bliver en valenselektron. Dette er en midlertidig stat, og elektronet vender normalt tilbage til sin jordtilstand.
* ionisering: Hvis et atom mister et elektron, bliver de resterende elektroner i den yderste skal Valenselektroner. Dette er en permanent ændring og skaber en ion.
Eksempel:
Overvej et natriumatom (NA). Det har en valenselektron i sin yderste skal. De indre skaller indeholder ikke-valenselektroner.
* excitation: Hvis natrium absorberer energi, kan en af dens ikke-valenselektroner midlertidigt være glade for et højere energiniveau og blive en valenselektron. Imidlertid er denne tilstand ustabil, og elektronet falder til sidst tilbage og vender tilbage til sin ikke-valenstilstand.
* ionisering: Hvis natrium mister sin enkle valenselektron, bliver det en natriumion (Na+). Nu betragtes elektronerne i den næste indre skal som valenselektroner, selvom de oprindeligt var ikke-valenselektroner.
Vigtig note: Udtrykket "valenselektron" er normalt reserveret til elektroner i den yderste skal af et atom i dens jordtilstand. Elektroner i ophidsede eller ioniserede tilstande kaldes typisk ikke valenselektroner, skønt de kan deltage i binding i disse tilstande.
 Varme artikler
Varme artikler
-
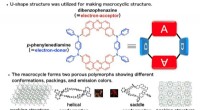 Unikke organiske lys-emitterende molekylære emittereFig. 1 Skematisk forklaring af det udviklede TADF-aktive makrocykliske materiale. Kredit:Osaka University Et hold med forskere fra Osaka University har produceret en ny molekylær emitter til organ
Unikke organiske lys-emitterende molekylære emittereFig. 1 Skematisk forklaring af det udviklede TADF-aktive makrocykliske materiale. Kredit:Osaka University Et hold med forskere fra Osaka University har produceret en ny molekylær emitter til organ -
 Et termisk styringsmateriale, der reagerer på varme eller kulde ved at folde eller folde ud uden be…Inspireret af Mimosa pudica-blade vælger enheden intelligent den rigtige termiske styringstilstand ved at modulere dens morfologi. Kredit:Quan Zhang Et team af forskere ved Nankai University har ud
Et termisk styringsmateriale, der reagerer på varme eller kulde ved at folde eller folde ud uden be…Inspireret af Mimosa pudica-blade vælger enheden intelligent den rigtige termiske styringstilstand ved at modulere dens morfologi. Kredit:Quan Zhang Et team af forskere ved Nankai University har ud -
 Materialeforskere skaber stofalternativer til batterier til bærbare enhederUMass Amherst-forskere ledet af materialekemiker Trisha L. Andrew rapporterer, at de har udviklet en metode til at lave et ladningsopbevarende system, der nemt kan integreres i tøj til at brodere et l
Materialeforskere skaber stofalternativer til batterier til bærbare enhederUMass Amherst-forskere ledet af materialekemiker Trisha L. Andrew rapporterer, at de har udviklet en metode til at lave et ladningsopbevarende system, der nemt kan integreres i tøj til at brodere et l -
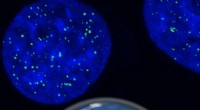 Forskere har sporet en uhåndgribelig sammenfiltret knude af DNAKunstnerens indtryk af i-motivets DNA-struktur inde i celler, sammen med det antistofbaserede værktøj, der bruges til at opdage det. Kredit:Chris Hammang Det er DNA, men ikke som vi kender det. I
Forskere har sporet en uhåndgribelig sammenfiltret knude af DNAKunstnerens indtryk af i-motivets DNA-struktur inde i celler, sammen med det antistofbaserede værktøj, der bruges til at opdage det. Kredit:Chris Hammang Det er DNA, men ikke som vi kender det. I
- Hvad er den strukturelle formel for natriumcarbonat?
- Koncertpromotorer vender sig væk fra teknikken til ansigtsgenkendelse
- Hvad er bredden på Mount Crater?
- Hvor mange penge ønsker folk at opnå deres ideelle liv? Vores forskning gav et overraskende result…
- Hvordan opdelte Linnaeus organismer i grupper-grupperne var baseret på hvad?
- Selvom tropiske regnskove har rig vegetation, er de naturlige forhold ikke gunstige for landbruget?


