Hvilken temperatur vil xenonatomer have samme gennemsnitlige hastighed, som CL2 -molekyler ved 24 grader C?
1. Forstå koncepterne
* Gennemsnitlig hastighed på gasser: Den gennemsnitlige hastighed for gasmolekyler er relateret til deres temperatur og molmasse.
* rod-middel-kvadrathastighed (VRMS): En almindelig måde at udtrykke den gennemsnitlige hastighed for gasmolekyler er rod-middel-kvadrathastigheden. Formlen er:
VRMS =√ (3RT/M)
hvor:
* R er den ideelle gaskonstant (8.314 j/mol · k)
* T er temperaturen i Kelvin
* M er den molære masse i kg/mol
2. Opret ligningen
Vi ønsker, at VRMS af Xenon (XE) skal være lig med VRMS for klorgas (CL2) ved 24 ° C. Lad os kalde temperaturen på Xenon TX:
√ (3r*tx/mxe) =√ (3r*tcl2/mcl2)
3. Konverter temperaturer til Kelvin
* Tcl2 =24 ° C + 273,15 =297,15 K
4. Bestem molære masser
* Mxe =131,29 g/mol =0,13129 kg/mol
* MCL2 =2 * 35,45 g/mol =70,90 g/mol =0,07090 kg/mol
5. Løs for TX
Da '3R' -sigt vises på begge sider, annullerer den. Vi kan forenkle ligningen og løse for TX:
√ (tx/mxe) =√ (tcl2/mcl2)
Firkantet begge sider:
TX/MXE =TCL2/MCL2
Løs for TX:
TX =TCL2 * (MXE/MCL2)
6. Beregn tx
TX =297,15 K * (0,13129 kg/mol/0,07090 kg/mol)
TX ≈ 552,7 K
7. Konverter tilbage til Celsius
TX ≈ 552,7 K - 273,15 =279,55 ° C
Derfor vil xenonatomer have den samme gennemsnitlige hastighed som CL2 -molekyler ved 24 ° C, når xenon er på ca. 279,55 ° C.
Sidste artikelHar væsker deres egen form?
Næste artikelHvor mange valenselektroner er der i et neutralt iodatom?
 Varme artikler
Varme artikler
-
 Molecular switch vil lette udviklingen af banebrydende elektro-optiske enhederEt forskerhold ved det tekniske universitet i München har udviklet molekylære nanoswitches, der kan skiftes mellem to strukturelt forskellige tilstande ved hjælp af en påført spænding. De kan tjene so
Molecular switch vil lette udviklingen af banebrydende elektro-optiske enhederEt forskerhold ved det tekniske universitet i München har udviklet molekylære nanoswitches, der kan skiftes mellem to strukturelt forskellige tilstande ved hjælp af en påført spænding. De kan tjene so -
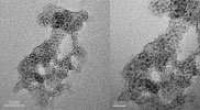 Porøs silica beskytter nikkelkatalysatorTransmissionselektronmikroskopi billeder af (venstre, center) nikkel-silica-katalysator og (til højre) en kommerciel katalysator. Kredit:Genoptrykt fra Ref. 1, Copyright 2018, med tilladelse fra Elsev
Porøs silica beskytter nikkelkatalysatorTransmissionselektronmikroskopi billeder af (venstre, center) nikkel-silica-katalysator og (til højre) en kommerciel katalysator. Kredit:Genoptrykt fra Ref. 1, Copyright 2018, med tilladelse fra Elsev -
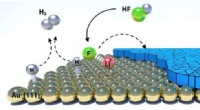 Batteriets skjulte lag afsløretReaktionsmekanismen til omdannelse af hydrogenfluorid (HF) urenhed fra elektrolytten til lithiumfluorid (LiF) i fast-elektrolytinterfasen (SEI) med frigivelse af hydrogengas (H2). SEI -laget er vist p
Batteriets skjulte lag afsløretReaktionsmekanismen til omdannelse af hydrogenfluorid (HF) urenhed fra elektrolytten til lithiumfluorid (LiF) i fast-elektrolytinterfasen (SEI) med frigivelse af hydrogengas (H2). SEI -laget er vist p -
 Forstå, hvad der gør sort pigment sortKredit:CC0 Public Domain Forskere har for første gang ublandet det sorte pigment, der farver vores hud og giver bananerne deres pletter. Forskere ved Ohio State University udførte arbejdet med eu
Forstå, hvad der gør sort pigment sortKredit:CC0 Public Domain Forskere har for første gang ublandet det sorte pigment, der farver vores hud og giver bananerne deres pletter. Forskere ved Ohio State University udførte arbejdet med eu
- Sådan adskilles alkohol fra vand
- Afslutning af global plantesporing, Proba-V tildelt nyt fokus
- Forskning kaster lys over virkningen af forsikringsudbetalinger efter katastrofe
- Er en stjerne en del af dit solsystem?
- Hvad er et opløsningsmiddellim?
- Hvad sker der med bølgelængde og størrelsen af hastighedsvandbølger, når det reflekteres?


